在人类辅助生殖技术临床实践中,对于卵巢低反应(poor ovarian response,POR)人群的治疗仍然面临巨大的挑战,这部分患者通常卵巢储备功能下降,获得的卵母细胞数量较少,活产率较低,取消周期率较高[1]。随着生育政策的调整及高龄人群生育需求的增加,在全球范围内,POR人群寻求辅助生殖技术治疗的比率都有不同程度的增长[2-3],因此在真实世界对这部分人群进行临床治疗的随访、分析,研究意义重大。2011年Ferraretti等学者[4]运用博洛尼亚标准首次对POR人群进行了划分,标准化了POR人群的定义。由于该标准存在局限性,2016年波塞冬工作小组制定了新的标准[5],该标准综合了年龄、抗缪勒管激素(anti-Müllerian hormone,AMH)及窦卵泡数(antral follicle count,AFC)对POR人群进行了更为细致的分类,但其在临床卵巢反应的评估及预测作用,尚待更多的数据去验证。本研究基于波塞冬(POSEIDON)标准对卵巢低反应人群进行临床结局的分析,进一步探讨POSEIDON标准在反映控制性促排卵预后中的作用,以期为临床治疗提供基础。
对象与方法
1.研究对象:2020年1月至2021年12月在本院生殖医学中心行辅助生殖治疗的POR患者3 702例,基于POSEIDON标准将患者分成4组:A组1 887例,年龄<35岁,AMH≥1.2 ng/mL;B组696例,年龄≥35岁,AMH≥1.2 ng/mL;C组623例,年龄<35岁,AMH<1.2 ng/mL;D组496例,年龄≥35岁,AMH<1.2 ng/mL。根据获卵数是否小于4枚,对A组、B组进行了亚组分类,即A1组获卵数<4枚,A2组获卵数为4~9枚;B1组获卵数<4枚,B2组获卵数为4~9枚。根据POSEIDON 标准,按AMH、年龄和获卵数指标可判定A组、B组具有较好的卵巢储备,定义为预期外的POR群体;C组和D组卵巢储备不良,定义为预期内的POR群体。
2.治疗方案:根据患者情况采用下列促排卵方案进行促排。
(1)长方案。月经周期第2~4天注射长效促性腺激素释放激素GnRHa(曲普瑞林,达必佳,每支3.75 mg,瑞士辉凌公司),达到降调节标准(血清促黄体生成素LH<5 IU/L,血E2<50 pg/mL,子宫内膜厚度内膜<4~5 mm,无功能性囊肿,双侧卵泡直径在4~6 mm)时,给予基因重组卵泡刺激素rFSH(果纳芬,瑞士雪兰诺公司),起始剂量为100~300 IU,用药4 d后经阴道超声监测卵泡发育同时检测血清LH、E2、P水平,根据患者个体差异定期酌情调整用药剂量直至hCG日。
(2)拮抗剂方案。月经周期第2~3天给予rFSH(果纳芬,瑞士雪兰诺公司),起始剂量为150~300 IU,用药4 d后经阴道超声监测卵泡发育,同时检测血清LH、E2、P水平,根据患者个体差异定期酌情调整用药剂量。当E2≥300 pg/mL并且卵泡≥12 mm或卵泡≥14 mm使用皮下注射拮抗剂醋酸西曲瑞克(思则凯,默克公司)。
(3)扳机时机。待主导卵泡直径达18~20 mm注射hCG 250 ug(德国默克雪兰诺有限公司)或hCG 10 000 IU(丽珠集团丽珠制药厂),36 h后在 B 超引导下无菌穿刺取卵。
3.授精:(1)体外授精(in vitro fertilization,IVF)。取卵后置于 IVF(Vitrolife,Sweden)微滴中培养3 h,加入精子后共孵育5~6 h,通过在倒置显微镜下观察第二极体排出情况判断受精与否。(2)卵胞质内单精子注射(intracytoplasmic sperm injection,ICSI)。取卵后置于 IVF (Vitrolife,Sweden)微滴中培养3 h,用透明质酸酶(irvineScientific,USA)孵育后机械去除颗粒细胞,2 h后行卵子胞浆内单精子注射。
4.受精与胚胎评估:受精后置于 G1(Vitrolife,Sweden)序贯培养液中培养,16~18 h观察原核形成。取卵后48 h 观察卵裂情况,于 72 h 选择优质胚胎移植或冷冻,将第三天(D3)的分裂期胚胎转入囊胚培养液 G2(Vitrolife,Sweden)微滴中,继续培养2 d,观察囊胚发育情况。根据Garnder 囊胚分级法对囊胚进行分级[6],后续选择优质胚胎进行移植或冷冻。
5.妊娠结局的判定:胚胎移植后常规黄体支持,移植后4周B超检查见孕囊及原始心管搏动视为临床妊娠。
6.统计学方法:采用SPSS 25.0 软件对数据进行统计分析。结果以均数 ± 标准差![]() 或率(%)表示,组间比较采用单因素方差分析,率的比较采用χ2分析。P<0.05为差异有统计学意义。
或率(%)表示,组间比较采用单因素方差分析,率的比较采用χ2分析。P<0.05为差异有统计学意义。
结果
1.四组患者基础资料比较:表1显示了所有POR患者的周期基础资料,共有3 702个周期符合纳入研究的条件。POSEIDON标准下,各组患者之间年龄、基础AMH和窦卵泡数差异有统计学意义,A组和C组的患者更年轻(P<0.05),平均年龄分别是(30.0±2.7)岁和(30.5±2.6)岁。在获卵数相同的亚组中,A1组较B1组年轻,A2组较B2组年轻,差异有统计学意义。各组的平均体质指数(BMI)均<25 kg/m2。在A组和C组中平均不孕持续时间为38个月左右,在B组和D组中高龄患者较多,不孕持续时间在48个月左右,差异有统计学意义。在A组和C组中原发性不孕类型占比较高(56.5%和55.5%),而在B组和D组中继发性不孕患者较多(69.8%和75.8%)。不孕原因中女方因素是最常见的原因,在卵巢储备较好群体中,低龄组促性腺激素(gonadotropin,GN)总量少于高龄组(P<0.05),A组和 B 组分别为(2 148.9±661.4)和(2 301.4±694.1);在卵巢储备较差的群体中,C组和D组分别为(2 239.0±798.5)和(2 185.7±763.6),低龄组有用量略大的趋势,但差异无统计学意义。对A组、B组进行亚组分类后,发现在获卵数为4~9枚的人群中,低龄组的GN用量少于高龄组(P<0.05),A2组和B2 组分别为(2 151.6±659.1)和(2 316.9±677.8);在获卵数小于4的亚组中,低龄组的GN用量相对少于高龄组,但差异无统计学意义,A1组和 B1 组分别为(2 092.9±711.0)和(2 207.8±782.4)。如果按相同年龄组进行比较,结果发现卵巢储备较好的POR人群在两个年龄组中GN的用量没有明显规律。
表1 四组患者基础资料比较![]()
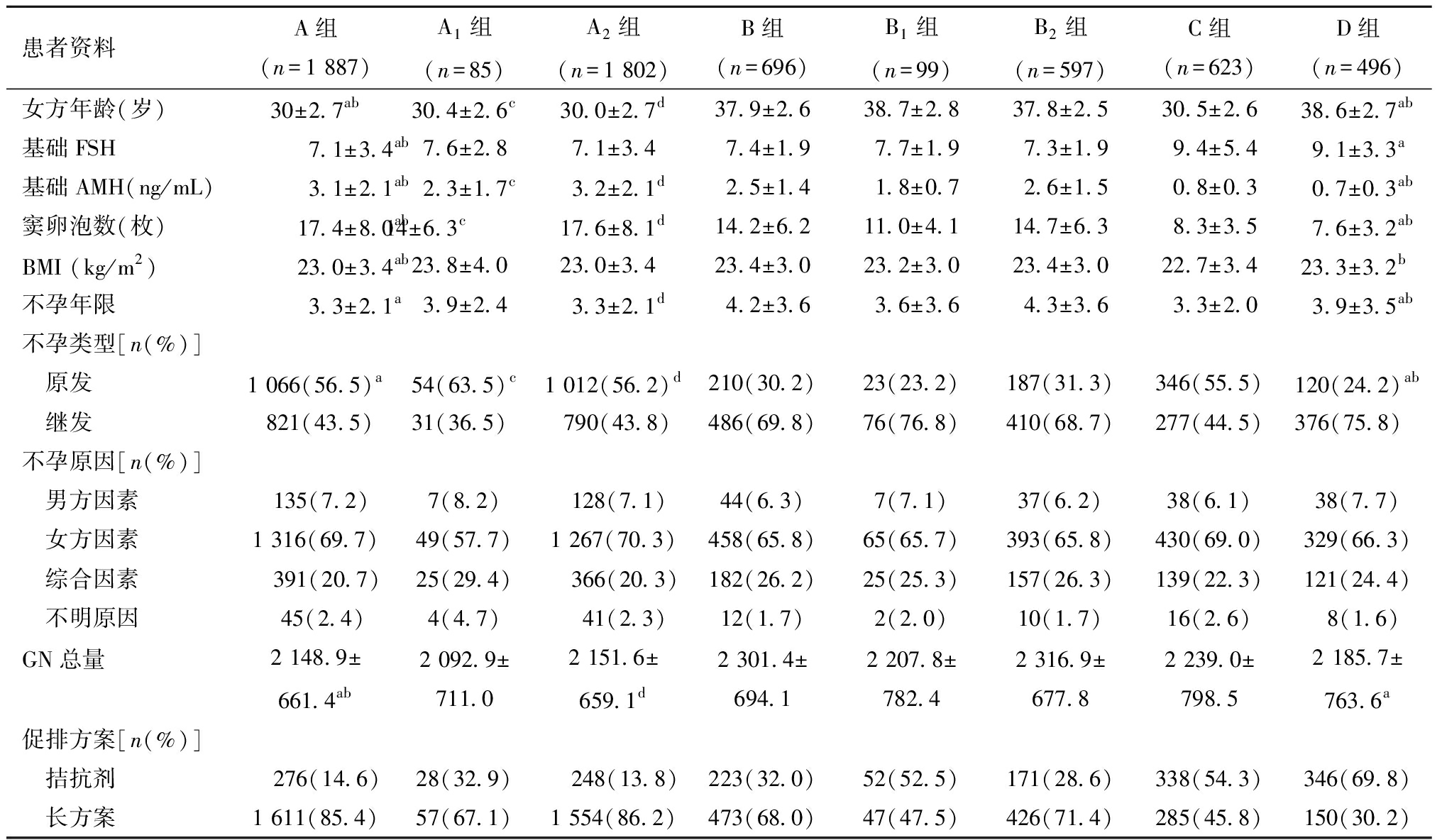
患者资料A组(n=1 887)A1组(n=85)A2组(n=1 802)B组(n=696)B1组(n=99)B2组(n=597)C组(n=623)D组(n=496)女方年龄(岁)30±2.7ab30.4±2.6c30.0±2.7d37.9±2.638.7±2.837.8±2.530.5±2.638.6±2.7ab基础FSH7.1±3.4ab7.6±2.87.1±3.47.4±1.97.7±1.97.3±1.99.4±5.49.1±3.3a基础AMH(ng/mL)3.1±2.1ab2.3±1.7 c3.2±2.1 d2.5±1.41.8±0.72.6±1.50.8±0.30.7±0.3 ab窦卵泡数(枚)17.4±8.0ab14±6.3 c17.6±8.1d14.2±6.211.0±4.114.7±6.38.3±3.57.6±3.2 abBMI (kg/m2)23.0±3.4ab23.8±4.023.0±3.423.4±3.023.2±3.023.4±3.022.7±3.423.3±3.2b不孕年限3.3±2.1a3.9±2.43.3±2.1d4.2±3.63.6±3.64.3±3.63.3±2.03.9±3.5ab不孕类型[n(%)] 原发1 066(56.5)a54(63.5)c1 012(56.2)d210(30.2)23(23.2)187(31.3)346(55.5)120(24.2)ab 继发821(43.5)31(36.5)790(43.8)486(69.8)76(76.8)410(68.7)277(44.5)376(75.8)不孕原因[n(%)] 男方因素135(7.2)7(8.2)128(7.1)44(6.3)7(7.1)37(6.2)38(6.1)38(7.7) 女方因素1 316(69.7)49(57.7)1 267(70.3)458(65.8)65(65.7)393(65.8)430(69.0)329(66.3) 综合因素 391(20.7)25(29.4) 366(20.3)182(26.2)25(25.3)157(26.3)139(22.3)121(24.4) 不明原因45(2.4)4(4.7) 41(2.3)12(1.7)2(2.0)10(1.7)16(2.6)8(1.6)GN总量2 148.9±661.4ab2 092.9±711.02 151.6±659.1d2 301.4±694.12 207.8±782.42 316.9±677.82 239.0±798.52 185.7±763.6 a促排方案[n(%)] 拮抗剂 276(14.6)28(32.9) 248(13.8)223(32.0)52(52.5)171(28.6)338(54.3)346(69.8) 长方案1 611(85.4)57(67.1)1 554(86.2)473(68.0)47(47.5)426(71.4)285(45.8)150(30.2)
注:与B组比较,aP<0.05;与C组比较,bP<0.05;与B1组比较,cP<0.05;与B2组比较,dP<0.05
2.四组患者获卵数及胚胎发育情况比较:表2显示了A组和B组卵巢储备较好,获得的卵母细胞总数和成熟卵子数均高于C组和D组,差异有统计学意义,A组、B组、C组和D组的卵母细胞总数分别为(7.0±1.8)、(6.1±2.2)、(4.8±2.2)和(4.0±2.0);A组、B组、C组和D组的成熟卵子数分别为(6.0±2.0)、(5.3±2.1)、(4.1±2.2)和(3.5±1.9);但是在卵巢储备较好的A、B组中依然是有部分群体获卵数小于4,在A组中占比4.5%(85/1 887),在B组中占比14.2%(99/696),高龄组中获卵数小于4的群体占比稍高一些。在胚胎发育方面,卵裂率四组之间差异无统计学意义。在卵巢储备良好的组中,囊胚形成率、可移植胚胎率低龄组(A组)优于高龄组(B组)(P均<0.05);囊胚形成率A1组高于B1 组,但差异无统计学意义,A2组高于B2 组(P<0.05);可移植胚胎率A1组与 B1 组差异无统计学意义,A2组高于B2 组(P<0.05);在卵巢储备不良的C组和D组中,囊胚形成率低龄组相对优于高龄组,但差异无统计学意义,可移植胚胎率低龄组优于高龄组(P<0.05)。如果按相同年龄组再进行比较,发现卵巢储备较好的POR人群(A组和B组)并没有拥有更好的胚胎发育潜能。
表2 四组患者获卵数、胚胎发育情况比较![]()
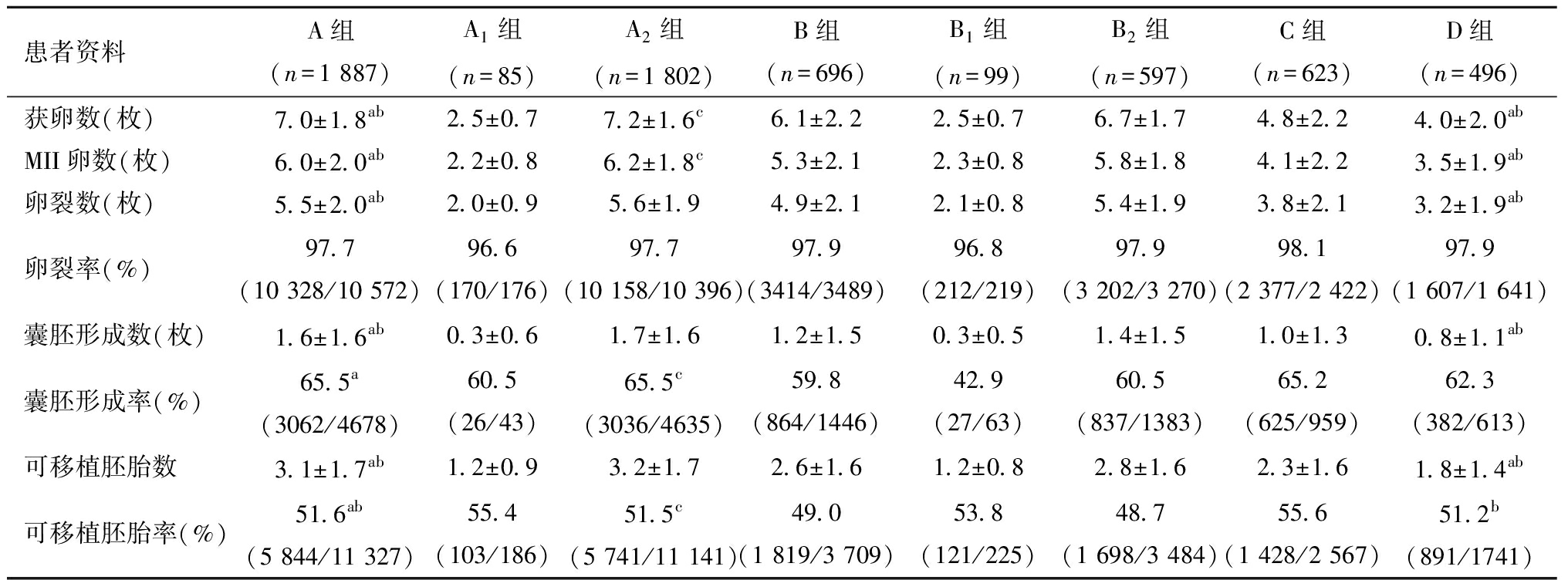
患者资料A组(n=1 887)A1组(n=85)A2组(n=1 802)B组(n=696)B1组(n=99)B2组(n=597)C组(n=623)D组(n=496)获卵数(枚)7.0±1.8ab2.5±0.77.2±1.6 c6.1±2.22.5±0.76.7±1.74.8±2.24.0±2.0abMII卵数(枚)6.0±2.0ab2.2±0.86.2±1.8c5.3±2.12.3±0.85.8±1.84.1±2.23.5±1.9ab卵裂数(枚)5.5±2.0ab2.0±0.95.6±1.94.9±2.12.1±0.85.4±1.93.8±2.13.2±1.9ab卵裂率(%)97.7(10 328/10 572)96.6(170/176)97.7(10 158/10 396)97.9(3414/3489)96.8(212/219)97.9(3 202/3 270)98.1(2 377/2 422)97.9(1 607/1 641)囊胚形成数(枚)1.6±1.6ab0.3±0.61.7±1.61.2±1.50.3±0.51.4±1.51.0±1.30.8±1.1ab囊胚形成率(%)65.5a(3062/4678)60.5(26/43)65.5c(3036/4635)59.8(864/1446)42.9(27/63)60.5(837/1383)65.2(625/959)62.3(382/613)可移植胚胎数3.1±1.7ab1.2±0.93.2±1.72.6±1.61.2±0.82.8±1.62.3±1.61.8±1.4ab可移植胚胎率(%)51.6ab(5 844/11 327)55.4(103/186)51.5 c(5 741/11 141)49.0(1 819/3 709)53.8(121/225)48.7(1 698/3 484)55.6(1 428/2 567)51.2b(891/1741)
注:与B组比较,aP<0.05;与C组比较,bP<0.05;与B2组比较,cP<0.05;卵裂率=卵裂数/受精数;囊胚形成率=囊胚形成数/囊胚培养数;可移植胚胎率=可利用胚胎数/成熟卵子数
3.四组移植患者的临床结局的比较:表3显示了四组移植患者的临床结局。在具有相同卵巢储备的患者中,低龄组POR人群有更好的临床结局,即在预期外POR人群中,临床妊娠率和活产率A组优于B组(P均<0.05);在预期内POR人群中,同样临床妊娠率和活产率C组优于D组(P均<0.05);对A组、B组进行亚组分类后分析发现,在获卵数4~9枚的群体中,以上指标依然是低龄组更具优势(P均<0.05);而在获卵数小于4枚的群体中,低龄组有优于高龄组的优势,但差异无统计学意义。如果按相同年龄组再进行比较,结果发现预期外的POR群体即卵巢储备较好的POR人群相对有更好的临床结局趋势,但差异无统计学意义;即在高龄患者中,临床妊娠率B组和D 组分别为53.8%和46.7%(P>0.05);活产率B组和D 组分别为41.1%和32.5%(P>0.05);在低龄患者中,临床妊娠率A组和C 组分别为66.8%和64.8%(P>0.05);活产率A组和C 组分别为56.4%和55.6%(P>0.05)。
表3 四组移植患者妊娠结局比较[n(%)]
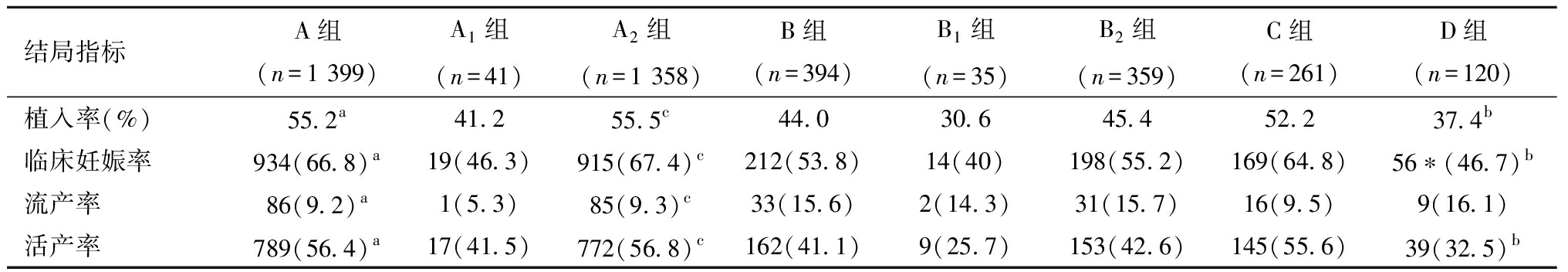
结局指标A组(n=1 399)A1组(n=41)A2组(n=1 358)B组(n=394)B1组(n=35)B2组(n=359)C组(n=261)D组(n=120)植入率(%)55.2a41.255.5 c44.030.645.452.237.4b临床妊娠率934(66.8)a19(46.3)915(67.4) c212(53.8)14(40)198(55.2)169(64.8)56∗(46.7)b流产率86(9.2)a1(5.3)85(9.3)c33(15.6)2(14.3)31(15.7)16(9.5)9(16.1)活产率789(56.4)a17(41.5)772(56.8) c162(41.1)9(25.7)153(42.6)145(55.6)39(32.5)b
注:与B组比较,aP<0.05;与C组比较,bP<0.05;与B2组比较,cP<0.05;植入率=植入胚胎数/总移植胚胎数;临床妊娠率=临床妊娠人数/总移植人数;流产率=流产人数/临床妊娠人数;活产率=活产人数/移植人数
讨论
随着“二孩”生育政策的全面放开,生育年龄的延迟,通过辅助生殖技术治疗的患者明显增多,在治疗前对患者进行充分评估,对临床治疗的决策及提高患者的依从性是至关重要的。POR人群由于卵巢储备功能下降,对Gn反应不佳,通常不能获得足够数量的优质卵母细胞,在临床治疗中面临更为严峻的挑战,因此对该类人群真实世界数据的探究及预后评估有着深远的意义。
2011年Ferraretti等制定了博洛尼亚标准,代表了科学界第一次以简单和可重复的方式标准化了POR人群的定义[4]。但是在临床试验中发现博洛尼亚标准诊断范围过于宽泛,可能会稀释临床治疗效果并且阻碍临床对亚组人群的管理[7]。2016年,波塞冬(POSEIDON)标准应运而出,该标准综合了年龄、AMH和AFC将POR人群分成了四组,在一定程度上降低了POR人群的异质性,对于POR人群具有不同的预测价值,这样更加有利于该类人群的个体化管理和治疗[5]。本研究根据POSEIDON分类系统进行评估后,表明波塞冬分型患者在日常实践中较为常见;患者年龄和卵巢储备是预测POR群体的重要指标,其中年龄是预测临床结局的关键参数。35岁正是波塞冬标准区分年轻和老年低预后患者的年龄界限,随着年龄增加原始卵泡库数量下降,卵母细胞质量下降,2019年的一项研究发现在年龄超过34岁的患者中胚胎的整倍体率急剧下降,这些患者可能需要更多的卵母细胞和胚胎来克服高龄对卵母细胞和胚胎质量的不利影响[8-9]。
在本研究中,A组和C组患者年龄较小,均<35岁,B组和D组患者年龄较大,均≥35岁,A组、B组具有较好的卵巢储备,是预期外的POR群体;C组和D组卵巢储备不良,是预期内的POR群体。首先A组和B组卵巢储备较好,获得的卵母细胞总数和成熟卵子数均高于C组和D组,差异有统计学意义,在胚胎发育方面,卵裂率四组之间差异无统计学意义。在卵巢储备良好的组中,囊胚形成率、可移植胚胎率低龄组优于高龄组,同时根据获卵数是否小于4枚对A组、B组进行了亚组分类并分析,结果发现,依然是低龄组更具优势,虽然在获卵数小于4枚的人群中,这种差异无统计学意义,可能与该类人群样本量少有关,后期还需要对这部分人群进行大样本的追踪和随访;在卵巢储备不良的组中,囊胚形成率低龄组优于高龄组,但差异无统计学意义,可移植胚胎率低龄组优于高龄组。如果按相同年龄组再行比较,即B组和D组比,A组和C组比,结果发现卵巢储备较好的POR人群并没有拥有更好的胚胎发育结局。统计移植患者的临床结局发现,在具有相同卵巢储备的患者中,低龄组POR人群有更好的临床结局,对A组、B组进行亚组分类后分析发现,在获卵数4~9枚的群体中,以上指标依然是低龄组更具优势,临床妊娠率A2组VS B2 组为67.4% vs 55.2%,活产率A2组vs B2 组为56.9% vs 42.6%;而在获卵数小于4枚的群体中,低龄组优于高龄组,但差异无统计学意义;如果按相同年龄组再行比较,结果发现卵巢储备较好的POR人群有相对更好的临床结局,但差异无统计学意义。在已有的几项中国的POR人群研究中也报道了类似的结果,认为年龄的预测作用相较于卵巢储备更为重要[10-11];但也有印度的学者认为在POR人群中,卵巢储备相较于女方患者的年龄对临床结局的预测更为重要[12],可能与不同人群有关。本研究认为年龄是预测临床结局的关键参数,在具有相同卵巢储备的患者中,低龄组POR人群有更好的临床结局;而当患者处于同一年龄层时,卵巢储备较高的患者有更好的临床结局趋势,但差异无统计学意义。
波塞冬标准的重点在于从“低反应”到关注“低预后”人群,这些发现可能有助于临床医生优化生殖诊疗策略,减轻低预后的风险。在临床宣教中需要强调女性年龄和卵巢储备对辅助生殖治疗的重要性,呼吁患者重视生活方式、早期诊断以及个体化治疗策略对提高治疗成功率的潜在作用。对于POSEIDONⅠ组和Ⅱ组,患者卵巢储备功能尚可,但是该类人群却发生了预期之外的卵巢反应不良,导致可利用胚胎数目减少、临床妊娠率不佳,可能要考虑排卵方案的选择,Gn的启动时间和剂量以及是否存在Gn抵抗,还包括年龄相关的黄体生成素(luteinizing hormone,LH)缺乏或者活性不足[13];POR人群可能存在LH受体的多态性,从促排开始补充重组LH可能改善患者对FSH的抵抗而改善这部分患者的临床结局[14]。对于POSEIDON Ⅲ 组和 Ⅳ组,这部分患者人群的特点是卵巢储备功能不理想,已报道的可能原因主要是染色体异常或者某些相关的基因突变或卵泡发育不同步等[15],有文献提示针对POSEIDON Ⅲ 组和 Ⅳ 组人群黄体期刺激方案会产生不同的效果[16]。如何改善POR人群的治疗结局依然是辅助生殖领域的难题,POSEIDON标准的提出改善了POR人群的异质性,更加有利于临床制定个体化的治疗策略以及开展一些辅助化治疗,但由于本回顾性研究样本数量有限,需要扩大样本量开展多中心试验做进一步的归纳总结。
1 Polyzos NP,Drakopoulos P,Parra J,et al.Cumulative live birth rates according to the number of oocytes retrieved after the first ovarian stimulation for in vitro fertilization/intracytoplasmic sperm injection:a multicenter multinational analysis including~15,000 women.Fertil Steril,2018,110:661-670.e1.
2 Christensen MW,Kesmodel US,Christensen K,et al.Early ovarian ageing:is a low number of oocytes harvested in young women associated with an earlier and increased risk of age-related diseases.Hum Reprod,2020,35:2375-2390.
3 Morin SJ,Patounakis G,Juneau CR,et al.Diminished ovarian reserve and poor response to stimulation in patients <38 years old:a quantitative but not qualitative reduction in performance.Hum Reprod,2018,33:1489-1498.
4 Ferraretti AP,La Marca A,Fauser BC,et al.ESHRE consensus on the definition of ′poor response′ to ovarian stimulation for in vitro fertilization:the Bologna criteria.Hum Reprod,2011,26:1616-1624.
5 Alviggi C,Andersen CY,Buehler K,et al.A new more detailed stratification of low responders to ovarian stimulation:from a poor ovarian response to a low prognosis concept.Fertil Steril,2016,105:1452-1453.
6 Gardner DK,Lane M,Stevens J,et al.Blastocyst score affects implantation and pregnancy outcome:towards a single blastocyst transfer.Fertil Steril,2000,73:1155-1158.
7 Papathanasiou A.Implementing the ESHRE ′poor responder′ criteria in research studies:methodological implications.Hum Reprod,2014,29:1835-1838.
8 Esteves SC,Carvalho JF,Martinhago CD,et al.Estimation of age-dependent decrease in blastocyst euploidy by next generation sequencing:development of a novel prediction model.Panminerva Med,2019,61:3-10.
9 Cimadomo D,Fabozzi G,Vaiarelli A,et al.Impact of maternal age on oocyte and embryo competence.Front Endocrinol (Lausanne),2018,9:327.
10 Shi W,Zhou H,Tian L,et al.Cumulative live birth rates of good and low prognosis patients according to POSEIDON criteria:A single center analysis of 18,455 treatment cycles.Front Endocrinol (Lausanne),2019,10:409.
11 Abdullah RK,Liu N,Zhao Y,et al.Cumulative live-birth,perinatal and obstetric outcomes for POSEIDON groups after IVF/ICSI cycles:a single-center retrospective study.Sci Rep,2020,10:11822.
12 Chinta P,Antonisamy B,Mangalaraj AM,et al.POSEIDON classification and the proposed treatment options for groups 1 and 2:time to revisit? A retrospective analysis of 1425 ART cycles.Hum Reprod Open,2021,2021:hoaa070.
13 中国ART治疗低预后人群诊疗专家意见编写组.基于Delphi法的辅助生殖技术治疗低预后人群诊疗中国专家意见.中华生殖与避孕杂志,2020,40:353-360.
14 Alviggi C,Conforti A,Esteves SC,et al.Recombinant luteinizing hormone supplementation in assisted reproductive technology:a systematic review.Fertil Steril,2018,109:644-664.
15 Alviggi C,Conforti A,Caprio F,et al.In Estimated good prognosis patients could unexpected "hyporesponse" to controlled ovarian stimulation be related to genetic polymorphisms of FSH receptor.Reprod Sci,2016,23:1103-1108.
16 Kale A,Kale A.Oocyte quality and blastocyst formation rate with dual stimulation in patients belonging to poseidon groups 3 and 4:A retrospective comparative study.J Obstet Gynaecol India,2023,73:57-61.