子宫内膜癌(endometrial carcinoma)是妇科常见的恶性肿瘤,据美国癌症协会数据显示,2020年美国子宫内膜癌新发病例65 620例,死亡12 590例,仅次于卵巢癌[1]。据2019年国家癌症中心统计,中国子宫内膜癌发病率为10.28/10万,死亡率为1.9/10万[2]。子宫内膜癌公认的危险因素包括长期的雌激素刺激、基因突变、肥胖、高血压、糖尿病、不孕和炎症等,但具体发病机制仍未完全阐明。近年来,由于高脂高热饮食和低运动量生活方式的影响,子宫内膜癌在中国的发病率呈上升趋势。因此,需要探索新型药物靶点和预后生物标志物,为子宫内膜癌患者提供更有效的个性化治疗和更好的预后。
2022年3月,Tsvetkov等[3]发表在《science》的一篇文章首次提出了铜死亡这一新型的程序性细胞死亡方式,它是通过铜离子直接结合三羧酸循环途径中的脂酰化成分,导致脂酰化蛋白异常聚集和铁硫簇蛋白丢失,引发蛋白质毒性应激反应并最终介导铜死亡的发生。已有文章报道铜死亡相关基因、LncRNA可作为肾透明细胞癌、肝细胞癌的预后标志物,并可能为肿瘤治疗提供新见解[4-5]。目前尚无铜死亡相关基因在子宫内膜癌方面的研究,利用生物信息学方法研究铜死亡相关基因对子宫内膜癌的预后价值并建立预后模型,以期为子宫内膜癌患者提供新的治疗策略。
资料与方法
1.数据来源:子宫内膜癌基因获取:从肿瘤基因图谱(the cancer genome atlas,TCGA)数据集官网下载548例子宫内膜癌组织临床信息,使用UCSC Xena(https://xena.ucsc.edu/)数据库当中的“GDC TCGA Endometrioid Cancer(UCEC)”链接下载572例子宫内膜癌组织基因表达矩阵及590例生存信息,将三者进行匹配并将生存信息、临床信息不完整的子宫内膜癌患者排除在外,最终得到520例子宫内膜癌样本和23例正常子宫内膜样本。
铜死亡基因集获取:通过阅读文献获得10个铜死亡相关基因(FDX1,LIAS,LIPT1,DLD,DLAT,PDHA1,PDHB,MTF1,GLS,CDKN2A),另外从GeneCards数据库(https://www.genecards.org/)获得1个铜死亡相关基因(SLC25A3)。
2.风险评分构建:结合患者的生存状态与生存时间,利用LASSO回归分析筛选预后相关的基因及相应的系数,并利用以下公式计算每一例患者的风险评分:风险评分=基因1的表达量×基因1的β1系数+基因2的表达量×基因2的β2系数+……+基因n的表达量×基因n的βn系数,其中β系数由R软件在多因素Cox回归分析时直接得出。以风险评分的中位数作为截断值,把子宫内膜癌患者分为高风险组和低风险组。
3.生物信息学分析:
(1)功能富集分析 应用DAVID在线生物信息学工具(https://david.ncifcrf.gov/)对铜死亡相关基因进行GO注释、KEGG信号通路分析,初步探讨铜死亡相关基因在子宫内膜癌中的潜在作用机制。
(2)HPA数据库分析蛋白表达 选取人类蛋白表达图谱数据库(Human Protein Atlas,HPA)中的免疫组织化学抗体,分析子宫内膜癌和正常子宫内膜组织中蛋白的表达及染色程度。
(3)关键调控基因外部验证 利用UALCAN数据库验证关键调控基因在子宫内膜癌和正常组织中的表达,并分析关键调控基因与子宫内膜癌患者预后的相关性。
4.统计学分析:统计分析均采用R语言软件(v 4.1.1)完成,所有检验均为双侧检验,P<0.05为差异有统计学意义。
(1)基因在子宫内膜癌组织和正常组织中表达的比较。利用R软件“ggplot2”、“grid”、“RColorBrewer”和“tidyr”包对铜死亡相关基因在子宫内膜癌和正常子宫内膜组织中的表达情况进行比较并绘制箱型图。
(2)风险评分分组比较。利用R软件“ggplot2”包对患者的风险评分进行分组比较,并用箱型图展示。
(3)生存分析。利用R软件“survival”和“survminer”包对高风险组和低风险组患者进行Kaplan-Meier生存分析并绘制生存曲线,利用R软件“timeROC”包绘制时间依赖性受试者工作特征(ROC)曲线,计算曲线下面积(AUC)。
(4)预后模型构建。将患者的年龄、临床分期、组织学分级和风险评分纳入多因素Cox分析并计算各因素的P和HR。根据患者的年龄、临床分期、组织学分级和风险评分,利用R软件“rms”包构建列线图并计算C值。
结果
1.TCGA数据库中铜死亡相关基因mRNA在子宫内膜癌及正常子宫内膜中的表达:铜死亡相关基因在子宫内膜癌及正常子宫内膜中的表达情况如图1所示,其中CDKN2A,FDX1,PDHA1,PDHB在子宫内膜癌中表达显著增高,GLS,LIAS,LIPT1,MTF1在子宫内膜癌中的表达显著低于正常子宫内膜,而DLAT,DLD,SLC25A3在肿瘤组织及正常组织中的表达差异无统计学意义。
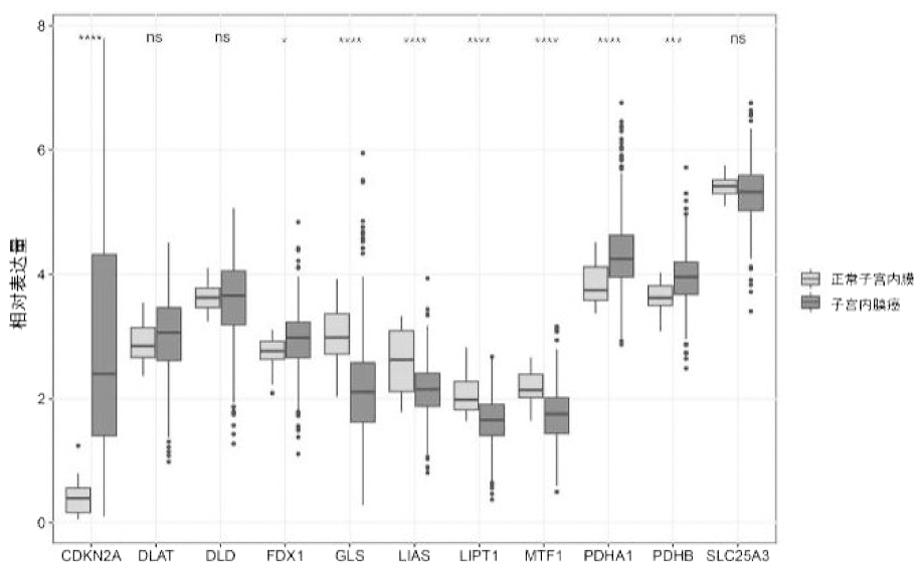
图1 子宫内膜癌和正常子宫内膜中铜死亡相关基因mRNA的表达差异
注:ns:没有统计学意义;*:P<0.05,**:P<0.01;***:P<0.001;****:P<0.0001
2.风险评分的构建:结合患者的生存时间、生存状态及铜死亡相关基因的表达量,使用LASSO回归分析,共筛选出3个预后相关的基因,根据以下风险计算公式,计算每一例患者发生子宫内膜癌的风险:风险评分=PDHA1的表达量×0.147+CDKN2A的表达量×0.185+GLS的表达量×0.193。按照患者风险评分从低到高的顺序展示各个患者的临床信息及生存信息(图2),从图中可直观的看出,随着风险评分的增高,患者年龄相对更高、临床分期更晚、肿瘤分化更差、预后更差。根据风险评分的中位数,将子宫内膜癌患者分为高风险组与低风险组,如图2和4所示,低风险组患者的预后明显优于高风险组(P=0.00015)。
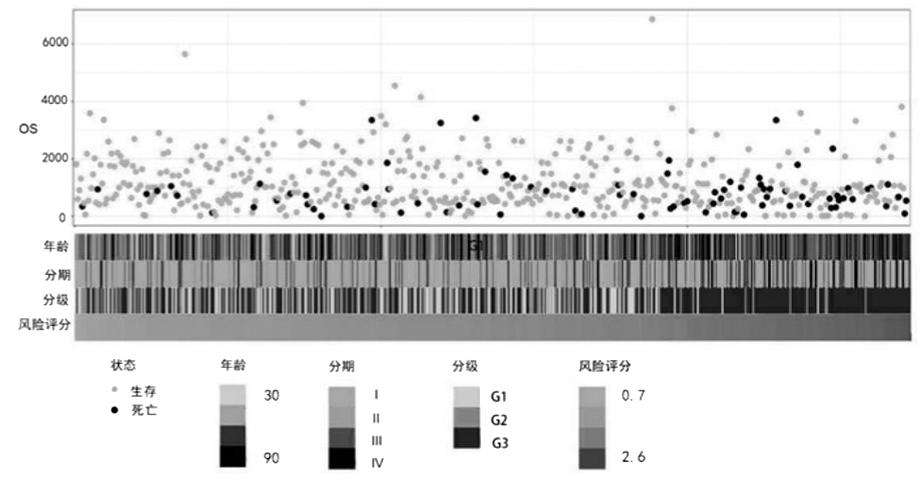
图2 各患者的临床信息、生存信息及风险评分热图
3.风险评分与子宫内膜癌患者临床特征的关系:在520例子宫内膜癌样本中,高分化98例(18.8%),中分化117例(22.5%),低分化305例(58.7%)。根据国际妇产科联合会(FIGO)分期系统,Ⅰ期325例(62.5%),Ⅱ期50例(9.6%),Ⅲ期119例(22.9%),Ⅳ期26例(5%)。如图3所示,患者年龄越大,风险评分越高(≥65岁 vs <65岁,P<0.0001);FIGO分期越高,患者风险评分越高(Ⅲ、Ⅳ期 vs Ⅰ、Ⅱ期,P<0.0001);且高风险评分预示着肿瘤分化更差(低-中分化 vs 高分化,P<0.0001)。总体来看,风险评分相对较高的子宫内膜癌患者FIGO分期相对更高且预后不良。
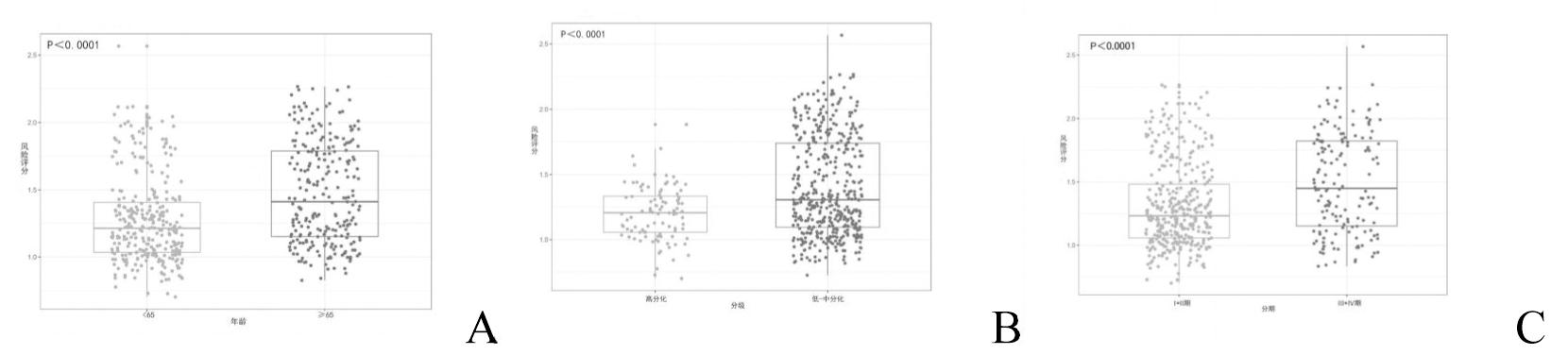
图3 风险评分与子宫内膜癌患者临床特征的关系(A-C:风险评分与子宫内膜癌患者年龄、组织学分级、临床分期的关系)

图4 高风险组与低风险组子宫内膜癌患者生存曲线的比较
4.功能富集:通过在线工具对铜死亡相关基因进行GO注释和KEGG分析,GO注释结果显示,铜死亡相关基因在生物过程中主要富集于丙酮酸乙酰辅酶A的合成等;在细胞组成中主要富集于线粒体基质、丙酮酸脱氢酶复合体等;在分子功能主要富集于丙酮酸脱氢酶(NAD+)活性等;KEGG分析结果提示,铜死亡相关基因主要富集于柠檬酸循环、丙酮酸代谢、糖酵解等信号通路,如图5所示。
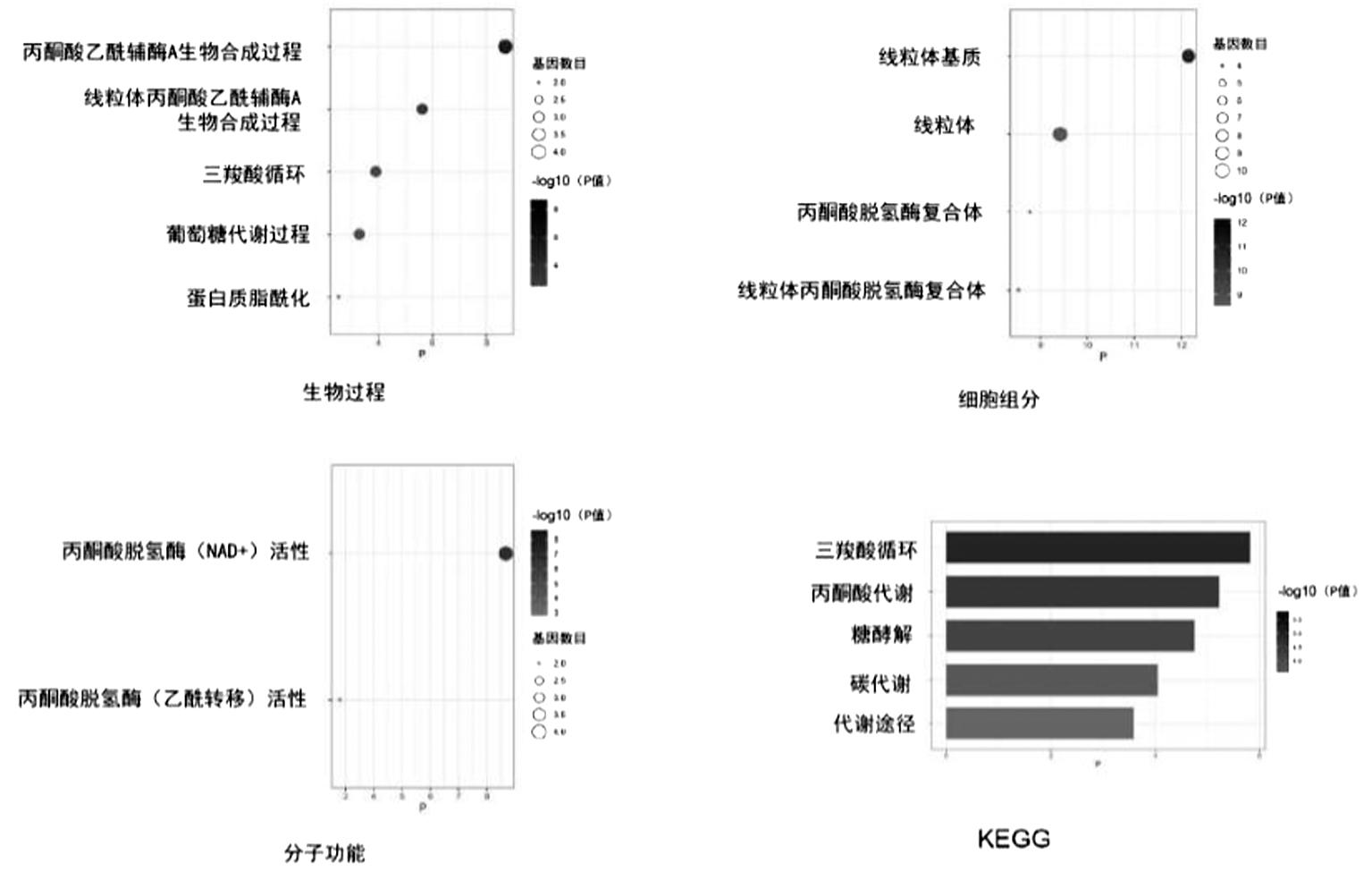
图5 铜死亡相关基因的GO注释和KEGG分析
5.风险评分与子宫内膜癌患者预后的关系:通过对年龄、组织学分级、临床分期及风险评分进行多因素Cox分析,发现风险评分是子宫内膜癌患者的独立不良预后因素(P<0.05,HR=2.12,95%CI:1.19~3.78)(图6)。时间依赖性ROC曲线分析结果表明风险评分预测子宫内膜癌患者1年、3年、5年预后的能力分别为61.08%、67.06%、68.91%,表明风险评分具有较好的预测能力,且1年、3年、5年的预测能力逐渐升高(图7)。
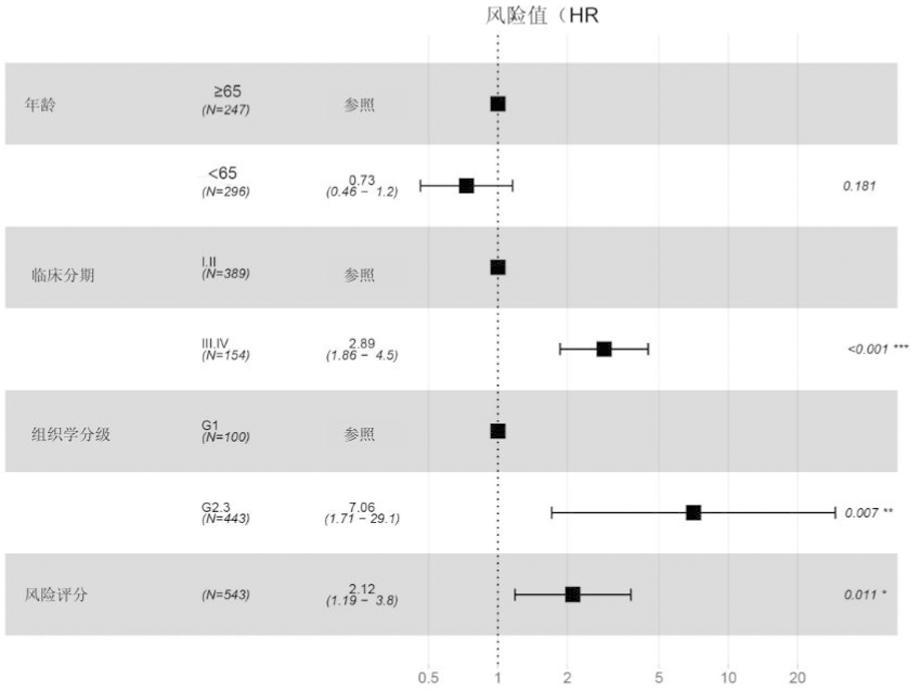
图6 影响子宫内膜癌患者总生存期的多因素Cox分析森林图
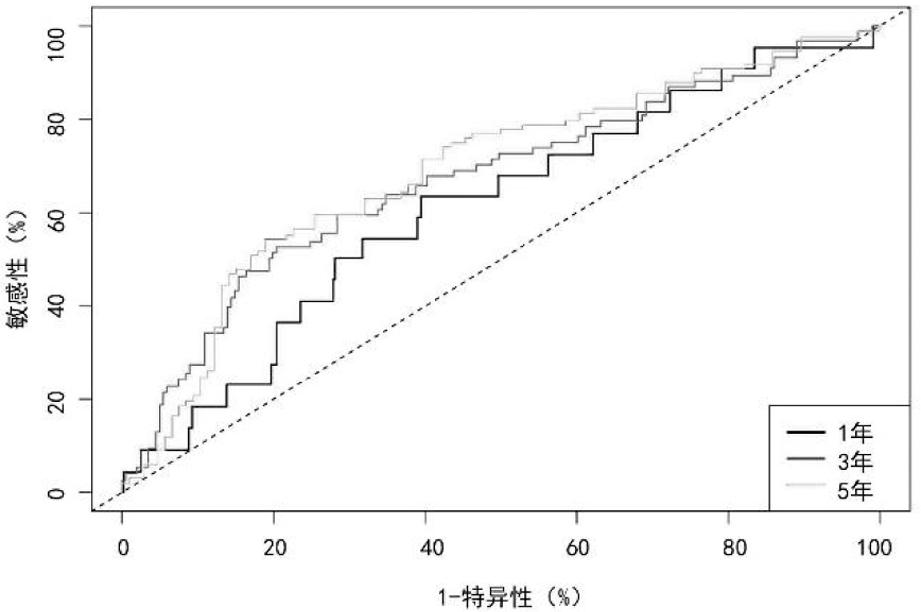
图7 风险评分评估子宫内膜癌患者预后的时间依赖性ROC曲线
6.预测模型的构建:纳入患者年龄、组织学分级、临床分期及风险评分构建临床预测模型列线图,以预测1年、3年、5年的生存概率(图8A)。所构建的预测模型及各临床参数的C指数如图8B所示,其中预测模型C指数最高,而风险评分和临床分期的C指数一致,提示该模型对子宫内膜癌患者生存率具有良好的预测能力,且风险评分和临床分期的预测能力相当。
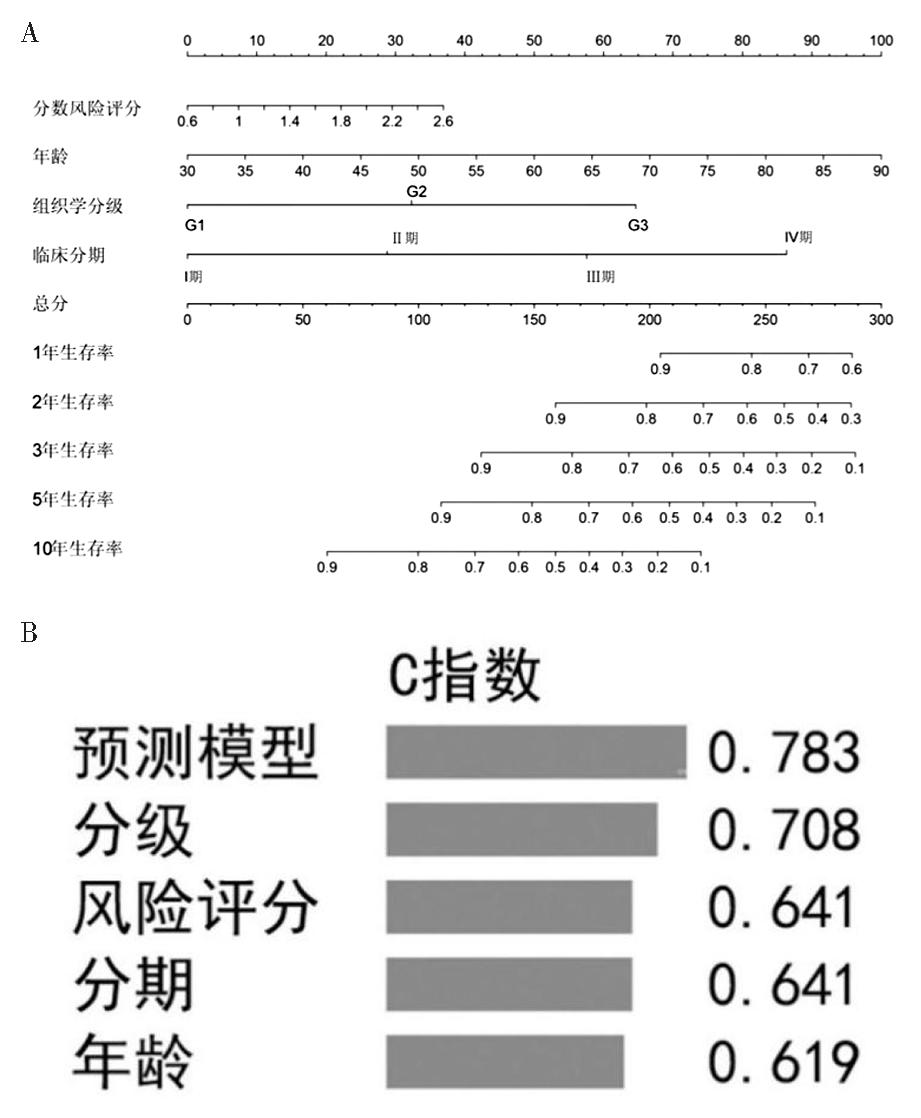
图8 预测模型列线图及C指数
A:预测子宫内膜癌患者1、3和5年总生存率的列线图;B:预测模型及各临床参数的C指数
7.关键调控基因蛋白在子宫内膜癌和正常子宫内膜中的表达比较:从HPA数据库收集CDKN2A、GLS、PDHA1蛋白在子宫内膜癌和正常子宫内膜组织中的免疫组化染色图谱,从蛋白表达水平比较基因在子宫内膜癌和正常子宫内膜组织中的差异。如图9A-B所示,与正常子宫内膜组织相比,CDKN2A蛋白在子宫内膜癌组织中的表达水平明显升高。CDKN2A蛋白在子宫内膜癌组织中的染色阳性率>75%,染色强度高,而在正常子宫内膜组织中的染色阳性率为25%-50%,染色强度较弱。
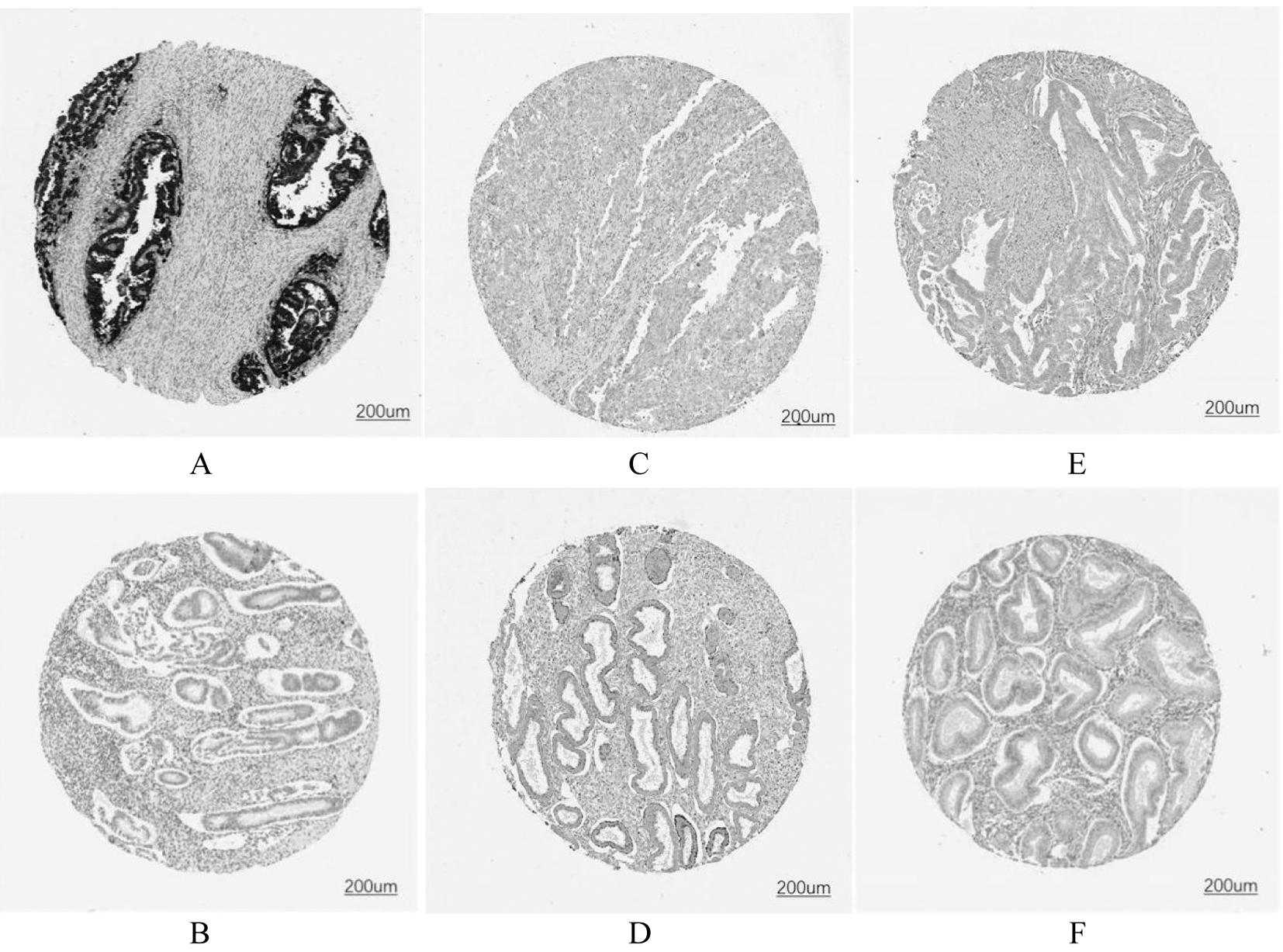
图9 免疫组化染色观察子宫内膜癌组织中关键调控基因蛋白的表达CDKN2A蛋白(A-B)、GLS蛋白(C-D)、PDHA1蛋白(E-F)在子宫内膜癌及正常子宫内膜组织中的表达水平(A、C、E:子宫内膜癌组织,B、D、F:正常子宫内膜组织)
与预期结果一致,GLS蛋白在子宫内膜癌组织中的表达水平明显降低(图9C-D)。GLS蛋白在子宫内膜癌组织中基本不染色或染色阳性率<25%,染色强度弱,而在正常子宫内膜组织中的染色阳性率为25%~50%,染色强度中等。
但PDHA1蛋白的表达情况不太满意(图9E-F),PDHA1蛋白在正常子宫内膜组织和子宫内膜癌组织中的表达水平均较低,染色阳性率均<25%,染色强度均较弱。这一结果可能与HPA数据库中收录的数据较少有关,未来需要更多的临床样本进行验证。
8.关键调控基因的外部验证:利用UALCAN中的TCGA数据库对CDKN2A、GLS、PDHA1这3个基因在子宫内膜癌和正常组织中的表达进行验证,发现CDKN2A、PDHA1在子宫内膜癌中高表达,GLS在子宫内膜癌中低表达,与分析结果一致(图10A)。同时利用UALCAN中的TCGA数据库分析关键调控基因对子宫内膜癌患者预后的影响,结果显示CDKN2A、GLS、PDHA1与子宫内膜癌患者总体生存率相关(图10B),且CDKN2A、GLS、PDHA1的表达越高,患者预后越差。
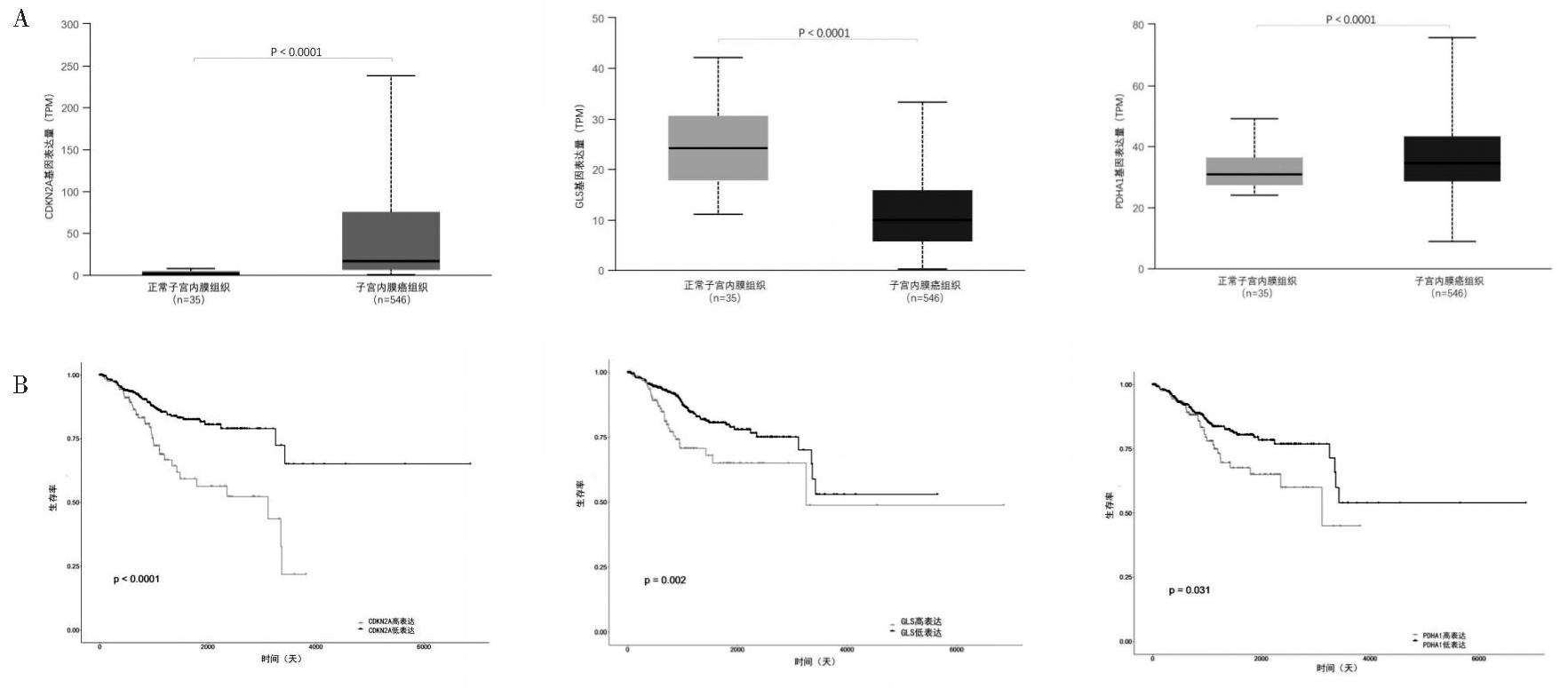
图10 关键调控基因的外部验证
A:UALCAN验证CDKN2A、GLS、PDHA1在子宫内膜癌和正常子宫内膜中的表达差异;B:UALCAN分析CDKN2A、GLS、PDHA1对子宫内膜癌患者预后的影响
讨论
铜是维持人类生命活动的基本元素,铜离子失调可导致多种疾病的发生[6]。最近多项研究表明,在乳腺癌、甲状腺癌、宫颈癌、卵巢癌、肺癌、前列腺癌等多种癌症中,患者血清及肿瘤组织中铜水平显著升高,表明细胞内铜水平的改变可能在肿瘤的发生和进展中发挥了重要作用[7],许多铜离子载体可通过促进铜中毒被用作抗癌剂[8]。
通过阅读文献获得了11个铜死亡相关基因,用生物信息学的方法分析显示,有8个(72.7%)基因在子宫内膜癌组织和正常子宫内膜组织中差异表达,提示铜死亡与子宫内膜癌密切相关,具有潜在的研究价值。应用LASSO回归分析最终筛选出3个基因用于建立风险评分,包括CDKN2A、GLS和PDHA1。
细胞周期素依赖性蛋白激酶抑制因子2A(cyclin dependent kinase inhibitor 2A,CDKN2A) 位于人类第9号染色体p21.3带上,在人体内细胞和组织上广泛表达,其编码两种蛋白质,包括p16INK4a和p14ARF。CDKN2A主要通过p16INK4a-CDK4/CDK6-pRb和p14ARF-MDM2-p53这两条途径对细胞周期进行调控。CDKN2A的缺失、突变和甲基化导致p16INK4a不能与CDK4和CDK6结合,使pRb蛋白磷酸化和转录调节因子E2F释放,引起细胞周期延长,有助于肿瘤的发生;同时导致p14ARF不能与MDM2结合,引发MDM2降解p53蛋白,诱发肿瘤。Su等[9]的分析结果表明CDKN2A高甲基化与子宫内膜癌的发生密切相关,且CDKN2A高甲基化可能是子宫内膜癌发生的早期事件。因此,检测CDKN2A高甲基化可能为预测早期子宫内膜癌发生提供有价值的标志物。此外,CDKN2A高甲基化的改变是可逆的,通过药物进行去甲基化治疗可能有助于延缓癌症发生和发展。已有文献报道在异种移植人子宫内膜癌的裸鼠中,5-氮杂-2-脱氧胞苷(AZA)对肿瘤生长的抑制率可达到79.1%[10]。这些研究表明CDKN2A基因靶向治疗可能在未来的研究中为癌症治疗带来新的方向和希望。
根据Bokhman分型,子宫内膜癌可分为I型雌激素依赖型和II型非雌激素依赖型。Zhou等[11]的研究表明,雌激素通过上调c-Myc致癌基因的表达增加谷氨酰胺酶(glutaminase,GLS)表达,进而促进雌激素敏感型子宫内膜癌细胞的生长,而雌激素受体拮抗剂氟维司群可逆转这些效应。GLS的主要功能是催化谷氨酰胺(L-Glutamine,Gln)水解为谷氨酸,Gln及其代谢产物可以为细胞生长提供原料,增强细胞增殖和生长。GLS的表达与肿瘤生长速度和恶性程度密切相关[12]。Zhou等[11]还发现外源性添加Gln加速了雌激素受体敏感型和非敏感型子宫内膜癌细胞的生长,而GLS抑制剂CB-839可逆转Gln的作用。这一结果表明GLS不仅对雌激素敏感型子宫内膜癌细胞有影响,也对非雌激素敏感型子宫内膜癌细胞有影响,因此猜测雌激素不是GLS活性的特定上游调节因子,在非雌激素依赖型子宫内膜癌中,GLS可能受TGF-β1等调节[13],这一作用机制需要进行更多的实验进行研究。
正常细胞的糖代谢包括无氧糖酵解和有氧氧化磷酸化。与正常细胞不同,肿瘤细胞即使在氧充足的条件下也以糖酵解代谢为主,这种现象称为Warburg效应或有氧糖酵解。现已证实,Warburg效应可促进肿瘤的发生、发展。丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex,PDC) 是糖代谢途径中的关键线粒体酶,可调节有氧呼吸与Warburg效应之间的比例。丙酮酸脱氢酶E1-α亚基(pyruvate dehydrogenase E1alpha,PDHA1)是PDC的主要组成成分,PDHA1的磷酸化和去磷酸化可调节其活性,从而调节细胞代谢过程[14]。Liu等[15]的研究表明,在食管鳞状细胞癌中,抑制PDHA1基因表达可增强Warburg效应,增强肿瘤细胞的迁移能力和对化疗药物的耐药性。已有文献报道PDHA1表达异常与包括胶质瘤[16]、肝癌[17]、食管鳞状细胞癌[15]等在内的多种癌症的发生发展密切相关。
多因素Cox分析显示基于铜死亡相关基因建立的风险评分是子宫内膜癌患者的独立不良预后因素,风险评分可区分高风险组和低风险组的病人,低风险组患者的预后明显优于高风险组。通过构建的预测模型列线图可预测子宫内膜癌患者的1年、3年、5年生存率,且预测性能良好,可为子宫内膜癌患者预后的评估提供临床指导。
1 Siegel R L,Miller K D,Jemal A.Cancer statistics,2020.CA:A Cancer Journal for Clinicians,2020,70(1):7-30.
2 中国抗癌协会妇科肿瘤专业委员会.子宫内膜癌诊断与治疗指南(2021年版).中国癌症杂志,2021,31:501-512.
3 Tsvetkov P,Coy S,Petrova B,et al.Copper induces cell death by targeting lipoylated TCA cycle proteins.Science,2022,375:1254-1261.
4 Bian Z,Fan R,Xie L.A Novel Cuproptosis-Related Prognostic Gene Signature and Validation of Differential Expression in Clear Cell Renal Cell Carcinoma.Genes (Basel),2022,13:851.
5 Zhang G,Sun J,Zhang X.A novel Cuproptosis-related LncRNA signature to predict prognosis in hepatocellular carcinoma.Sci Rep,2022,12:11325.
6 Ala Aftab,Ann P Walker,Keyoumars Ashkan,et al.Wilson′s disease.The Lancet,Elsevier,2007,369(9559):397-408.
7 Oliveri V.Selective targeting of cancer cells by copper ionophores:an overview.Front Mol Biosci.2022,9:841814.
8 Steinbrueck A,Sedgwick AC,Brewster JT 2nd,et al.Transition metal chelators,pro-chelators,and ionophores as small molecule cancer chemotherapeutic agents.Chem Soc Rev,2020,49:3726-3747.
9 Su L,Wang H,Miao J,et al.Clinicopathological significance and potential drug target of CDKN2A/p16 in endometrial carcinoma.Sci Rep,2015,5:13238.
10 晁红霞,孙建衡,陆士新.5-氮-2′-脱氧胞苷对人子宫内膜癌裸鼠移植瘤的p16基因去甲基化抑瘤作用.中华妇产科杂志,2000,35:229.
11 Zhou WJ,Zhang J,Yang HL,et al.Estrogen inhibits autophagy and promotes growth of endometrial cancer by promoting glutamine metabolism.Cell Commun Signal,2019,17:99.
12 Masisi BK,El Ansari R,Alfarsi L,et al.The role of glutaminase in cancer.Histopathology,2020,76:498-508.
13 Bernard K,Logsdon NJ,Benavides GA,et al.Glutaminolysis is required for transforming growth factor-β1-induced myofibroblast differentiation and activation.J Biol Chem,2018,293:1218-1228.
14 Chen J,Guccini I,Di Mitri D,et al.Compartmentalized activities of the pyruvate dehydrogenase complex sustain lipogenesis in prostate cancer.Nat Genet,2018,50:219-228.
15 Liu L,Cao J,Zhao J,et al.PDHA1 gene knockout in human esophageal squamous cancer cells resulted in greater warburg effect and aggressive features in vitro and in vivo.Onco Targets Ther.2019,12:9899-9913.
16 Yang Z,Wang Y,Zhang L,et al.Phosphorylated form of pyruvate dehydrogenase α1 mediates tumor necrosis factor α-induced glioma cell migration.Oncol Lett,2021,21:176.
17 Sun J,Li J,Guo Z,et al.Overexpression of pyruvate dehydrogenase E1α subunit inhibits warburg effect and induces cell apoptosis through mitochondria-mediated pathway in hepatocellular carcinoma.Oncol Res.2019,27(4):407-414.