·妇儿临床·
胆碱能抗炎通路在子痫前期患者母胎界面的表达及意义
郑林媚 施蕾 周忠义 陈小菊 王莉 唐荣 卢志诚
【摘要】 目的 探讨胆碱能抗炎通路在子痫前期患者母胎界面的表达及意义。方法2015年1月—2016年1月本院正常妊娠孕妇、轻度子痫前期患者和重度子痫前期患者各30例。采用qRT-PCR法和Western-blot法分别测定胎盘组织 α7 烟碱型乙酰胆碱受体(alpha-7 nicotinic acetylcholine receptor,α7nAChR) 的mRNA和蛋白表达,免疫组化法检测胎盘组织核因子-κB(nuclear factor-kB,NF-κB)蛋白表达,ELISA法测定胎盘组织白介素6(interleukin 6,IL-6)和肿瘤坏死因子(tumor necrosis factor α,TNF-α)蛋白水平。结果①轻度子痫前期组胎盘组织中α7nAChR mRNA的表达水平明显高于对照组和重度组(P<0.01),而重度组明显低于对照组,差异有统计学意义(P<0.05)。α7nAChR蛋白表达结果与mRNA结果基本一致。②子痫前期组胎盘NF-κB蛋白表达均较对照组显著增强,差异有统计学意义(P<0.05),且重度组显著高于轻度组(P<0.05)。③子痫前期组胎盘IL-6和TNF-α蛋白表达明显高于对照组,差异有统计学意义(P<0.05),且重度组显著高于轻度组(P<0.05)。结论胎盘组织中α7nAChR和NF-κB表达异常及炎症介质的增多可能与子痫前期发病有关,胆碱能抗炎通路可能参与子痫前期的发生、发展的病理生理过程。
【关键词】 子痫前期; 胆碱能抗炎通路; α7 烟碱型乙酰胆碱受体; 核因子-κB
子痫前期(preeclampsia,PE)是妊娠期特有且常见疾病,是产科中导致母儿发病率和死亡率的主要原因[1],其病因和确切发病机制至今尚未阐明。目前普遍认为子痫前期是一种母体系统性的过度性炎症反应,主要表现为母胎界面与炎症反应及细胞因子有关的炎性细胞激活、血管内皮细胞的功能紊乱和损伤以及滋养细胞的迁移受限、浅着床。Borovikova在2000年首次提出“胆碱能抗炎通路(cholinergic anti-inflammatory pathway, CAP)”[2],即炎症刺激信号通过迷走神经传入,经中枢神经系统将信息整合后,传出至神经末梢释放乙酰胆碱(acetylcholine, ACh),作用于炎症细胞上的α7 烟碱型乙酰胆碱受体(alpha-7 nicotinic acetylcholine receptor, α7nAChR),抑制促炎细胞因子释放。研究证实子痫前期患者较正常妊娠孕妇晚期ACh增加,推测胆碱能抗感染通路可能与子痫前期发病之间有一定联系[3]。但该通路在子痫前期中是否发挥作用以及如何作用,目前尚不清楚。本试验旨在通过测定正常妊娠孕妇和子痫前期患者胎盘组织中α7nAChR及核因子-κB(nuclear factor-kB,NF-κB)的表达水平及相关炎症因子的变化及其意义,探讨胆碱能抗炎通路与子痫前期的关系,为研究子痫前期发病机制及防治策略提供新的概念和理论依据。
对象与方法
一、研究对象
选择2015年1月~2016年1月海南省人民医院医院妇产科住院分娩的子痫前期患者60例,其中轻度子痫前期30例,重度子痫前期30例。选择同期正常孕妇30例为对照组。子痫前期组孕妇均因病情需要行剖宫产术终止妊娠,对照组孕妇均因社会因素行剖宫产术终止妊娠。子痫前期的诊断与分类参照谢辛主编的第8版《妇产科学》[4]。孕妇年龄、孕产次和孕前BMI比较,差异均无统计学意义(P>0.05),重度子痫前期组孕妇孕周与对照组比较,差异有统计学意义(P<0.05)。见表1。所有病例均无其他产科并发症及内外科合并症。胎盘组织标本经患者获取知情同意书后进行。
Table 1 Clinical characteristics of all participants

GroupNAge(years)GravidityParitygestationalage(weeks)BMI beforepreganancy(Kg/m2)Control3028.3±2.23.2±0.22.2±0.438.0±1.020.5±2.1Mild preeclampsia3029.2±2.13.3±0.42.4±0.336.2±1.119.3±2.5Severe preeclampsia3030.2±2.53.1±0.32.1±0.334.6±1.6*21.2±2.0
Note:*compared to control,P< 0.05
二、研究方法
1.标本采集
胎盘娩出5 min内取胎盘标本,在胎盘中央母体面靠近脐带血管处(避开出血、梗死和钙化区),取胎盘组织块大小约2 cm × 2 cm ×2 cm,一块用生理盐水漂洗后,置于无RNA酶的无菌冻存管中,于-80 ℃冰箱中保存;另一块用 10% 中性福尔马林液固定,制备石蜡切片。
2.qRT-PCR定量检测胎盘组织α7nAChR mRNA的表达
按Trizol 试剂的使用操作步骤提取胎盘组织总RNA,进行RNA 的琼脂糖凝胶电泳检测总RNA的纯度。以β-肌动蛋白(β-actin)基因为内参,按照 Thermo公司 RevertaidTM First Strand cDNA Synthesis Kit 说明书,将各样本总RNA进行反转录为cDNA。接着应用 SYBR Green I 荧光染料技术行实时定量 PCR 反应, 以 cDNA 为模板,建立RT-qPCR 反应体系,总的反应体积是20 μl。α7nAChR的TaqMan探针由北京君诺德生物技术有限公司设计并合成引物,α7nAChR上游引物序列5′- TTT CGT TTC ATG CAC TGG ACC CC-3′,下游引物序列5′- GGT TGC GAT TGG CGA ACC TGT TC-3′;β-actin上游引物序列5′- CCC AGA ATC TAC TAT CAC GAG TAC GAC GC -3′,下游引物序列5′- AAT CAC GAC GAT CGC ATA TTT ACG CAA CA-3′。根据PCR 产物熔解曲线的平均熔解温度确定产物的纯度。以Ct 值校正目的基因Ct 值,实验结果采用2﹣ΔΔCt法,计算目的基因mRNA 转录水平的差异。
3. Western-blot法检测胎盘α7nAChR蛋白的表达
严格按照试剂盒说明书提取胎盘总蛋白,以标准蛋白作为对照,酶标仪检测OD值,计算蛋白浓度。经SDS PAGE凝胶电泳后转PVDF 膜后在封闭液中封闭2小时,随后加入1∶800一抗孵育24 h ,二抗孵育1∶1000 2 h,漂洗滤膜后加入DAB显色剂显色,晾干硝酸纤维素膜,在凝胶成像系统上拍照,结果用Image J软件分析,以目的条带密度与β-actin光密度比值作为目的条带的相对参数。
4.免疫组化方法检测胎盘组织NF-κB的蛋白表达
将石蜡切片进行脱蜡和水化,并进行抗原修复,加入内源性过氧化氢阻断剂孵育10 min,随后加入1∶200兔抗人NF-κB65 37℃孵育60 min,再滴加增强1∶500酶标山羊抗兔 IgG聚合物孵育20 min,最后DAB显色,苏木素复染,镜下观察。NF-κB阳性表达的判定:细胞核、细胞质中染有棕黄色、褐色颗粒,计算阳性细胞百分比评分,5%为0分,5%~20%为1分,20%~50%为2分,50%~75%为3分,75%为4分;无着色0分,浅黄色1分,黄色2分,深黄色3分。两者相乘,0分为阴性,1~4分为+,5~8分为++,9~12 分为+++,++,+++均视为阳性。
5.胎盘组织中白介素6(interleukin 6,IL-6)和肿瘤坏死因子(tumor necrosis factor α,TNF-α)蛋白的检测
采用双抗体夹心ELISA法测定母血中IL-6和TNF-α蛋白的表达。ELISA试剂盒购自南京巴傲得生物科技有限公司。操作严格按试剂盒说明书进行。所有样品均设立复孔,均在同一批内检测。
6.统计学方法
采用SPSS 19.0统计软件进行数据处理, 上述各指标方法均重复测量5次,所得的数据结果取平均值。计量资料采用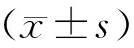 表示,多组均数比较采用方差分析,两样本均数比较采用独立样本的t检验,相关分析采用Pearson相关分析,以P<0.05位差异有统计学意义。
表示,多组均数比较采用方差分析,两样本均数比较采用独立样本的t检验,相关分析采用Pearson相关分析,以P<0.05位差异有统计学意义。
结 果
1.α7nAChR mRNA和蛋白在胎盘组织中的表达
轻度子痫前期组胎盘组织中α7nAChR mRNA的表达水平 (1.31 ± 0.12) 明显高于对照组和重度组 (0.62 ± 0.10;0.41 ± 0.08),而重度组明显低于对照组,差异有统计学意义(P﹤0.05)。α7nAChR蛋白在轻度子痫前期患者胎盘组织中的表达水平(0.78± 0.11)高于对照组和重度组 (0.36 ± 0.07;0.20 ± 0.06),与对照组相比较,重度组的α7nAChR蛋白表达明显下降,差异有统计学意义(P﹤0.05),见图1和图2。
2.免疫组化检测NF-κB蛋白胎盘组织的表达结果
NF-κB65主要表达于胎盘组织滋养细胞、血管内皮细胞、少量间质细胞的胞质及胞膜,呈棕褐色颗粒。与对照组相比,轻度子痫前期胎盘组织中的NF-κB蛋白表达显著上调(P<0.01),其NF-κB阳性表达率为 56.7%(17/30),高于对照组中的表达率26.7% (8/30),存在统计学差异 (χ2=11.286,P<0.01)。重度子痫前期的NF-κB蛋白阳性表达率为83.3%(25/30),与轻度子痫前期组比较,差异有统计学意义(χ2=14.464,P<0.01),见表2和图3。
Table 2 Expression of NF-κB in distinct histological placental tissue

GroupNNF-κBnegative (-)positive (+)Control30228Mild preeclampsia**301317Severe preeclampsia##30525
Note:**compared to control,P<0.01;##compared to mild preeclampsia,P<0.01
3. ELISA法测定胎盘组织中IL-6和TNF-α的表达变化。
IL-6和TNF-α在子痫前期患者胎盘组织中的水平高于正常妊娠组,差异有统计学意义(P<0.01),重度子痫前期组IL-6和TNF-α表达水平明显高于轻度子痫前期组,差异有统计学意义(P<0.05),见表3。

GroupN IL-6 TNF-αControl3028.12±9.1749.31±8.83Mild preeclampsia3037.65±11.34*60.12±10.16**Severe preeclampsia3063.42±8.21**/##80.55±12.14**/##
Note:*compared to control,P<0.05;**compared to control,P<0.01;##compared to mild preeclampsia,P<0.01
讨 论
子痫前期是妊娠特有多系统受累的疾病,是导致孕产妇和围产儿死亡的主要原因之一[5]。近年来研究显示子痫前期具有前炎性因子如细胞因子、趋化因子等过度表达的特征[6]。许多学者认为炎症反应在子痫前期病理过程以及胎儿宫内生长受限,HELLP综合征发挥着重要作用。胆碱能抗炎通路 (cholinergic anti-inflammatory pathways,CAP) 是指中枢神经系统与免疫系统之间存在一条能够拮抗炎症反应的通路,主要由迷走神经、ACh和α7-nAchR亚型构成,其机制为大脑识别传入迷走神经传来的信号,刺激迷走神经末梢释放Ach,与免疫细胞上表达的α7-nAchR结合,抑制致炎细胞因子的合成与释放,从而发挥抗炎作用[7]。
1986年Satyanarayana学者[8]发现合体滋养层细胞出现中度变性(如子痫前期、子痫和胎死宫内),并伴有Ach合成表达明显减少。Murthy等[9]通过测定子痫前期患者胎盘组织中的Ach水平,结果发现其Ach释放明显减少。据此,我们推测作为神经免疫调节的“胆碱能抗炎通路”可能参与其中。由Ach激活的α7nAChR是调节炎症反应的关键性分子[10]。体外研究显示:α 7nAChR受体在人脐静脉和微血管的内皮细胞上有着丰富的表达。但在缺氧、烟碱刺激后,人脐静脉内皮细胞α 7nAChR水平明显升高[11]。但也有学者的研究结果发现在缺血缺氧状态下,α7nAChR蛋白的表达下降[12]。本研究结果显示,α7nAChR mRNA在正常孕妇和子痫前期患者胎盘组织中均有表达,轻度子痫前期孕妇胎盘组织中α7nAChR mRNA表达水平明显高于对照组。有趣的是,进一步研究发现重度子痫前期组的α7nAChR mRNA与轻度子痫前期组相比明显下降,且重度组低于对照组,差异有统计学意义。同时Western-blot检测结果也证明与mRNA结果相一致,由以上研究可以推测能与Ach相结合的烟碱受体可能在子痫前期的发病过程中起一定作用。但与Rita Machaalani[13]等的结果并不一致,其研究结果发现子痫前期组中α7nAChR mRNA表达更高。分析认为这可能与作者未将子痫前期进行分类,如轻度型或重度型,及子痫前期状态下缺血缺氧的严重程度和持续时间等有关。
NF-κB是炎症因子基因表达的枢纽之一,被称为前炎症介质转录因子,激活诸如IL-1β、IL-6和TNF-α等的其他促炎细胞因子并扩增其他炎性介质,引起广泛的过度性炎症反应[14]。2001年Takcas就通过研究发现妊娠期高血压疾病患者的血浆可使NF-κB激活,且比正常妊娠组孕妇的活性增加2.5倍[15]。大量的研究表明,CAP是通过α7nAChR介导的抗炎通路抑制NF-κB途径完成的[16]。本研究结果显示,子痫前期患者胎盘NF-κB蛋白表达较正常妊娠组显著上调,且重度组的NF-κB蛋白表达明显高于轻度组。我们进一步测定胎盘组织IL-6和TNF-α的水平,发现子痫前期组的IL-6和TNF-α水平明显高于正常妊娠组,且重度组明显高于轻度组,与之前的研究结果相一致[17],提示炎症因子激活参与了子痫前期病理生理过程,其表达强弱可以在一定程度上显示子痫前期发生发展的严重程度。
子痫前期是个多因素、多机制的疾病,机体表现的炎症反应是一种复杂、交叉调节、互相协调的过程,并且与氧化应激反应密不可分[18],作用机制见图4。本研究结果显示轻度子痫前期状态下,机体代偿性激活胆碱能抗炎通路,α7nAChR表达增多,抑制NF-κB的激活,一定程度上抑制炎症反应。因此轻度子痫前期组的IL-6、TNF-α的表达虽然高于正常妊娠组,但明显低于重度子痫前期组。当进展到重度子痫前,局部胎盘组织存在氧化与抗氧化的失衡,而氧化应激导致中性粒细胞浸润及T细胞活化,加重炎症反应,造成内皮细胞严重受损,使机体代偿调控机制发生紊乱,引起母体免疫损伤,导致胆碱能抗炎通路受损,使胆碱能系统出现异常,α7nAChR表达减少甚至丢失,失去对NF-κB信号通路的抑制作用,使NF-κB表达增多,释放大量的毒性因子如炎性介质,使血管出现严重狭窄及重铸障碍。
目前,治疗子痫前期的唯一有效方式是终止妊娠。经证实,采用电刺激迷走神经和激活a7nAchR等方法激活胆碱能抗炎通路,对脓毒症、缺血再灌注损伤、呼吸机引起的急性肺损伤、结肠炎和类风湿性关节炎等疾病均有良好的保护作用。Liu Y等[19]研究发现尼古丁可通过激活CAP,抑制NF-κB等炎症因子的产生,且该作用与α7nAChR通路有关,认为胆碱能受体激动剂,如尼古丁等可通过抑制NF-κB的表达从而预防子痫前期发生发展。根据本研究的结果展开对电刺激迷走神经和a7nAchR激动剂的进一步研究,可能对子痫前期的发病机制以及防治提供新思路。
参考文献
1 Cheng,S B,Sharma,S.Preeclampsia and health risks later in life:an immunological link.Semin Immunopathol,2016,38:699-708.
2 Borovikova LV,Ivanova S,Naardi D,et al.Role of vagus nerve signaling in CNI-1493-mediated suppression of acute inflammation.Auton Neurosci,2000,85:141-147.
3 Blaauw J,Graaff R,Van Pampus MG,et al.Abnormal endothelium-dependent microvascular reactivity in recently preeclamptic women.Obstet Gynecol,2005,105:626-632.
4 谢幸,苟文丽.妇产科学.第8版.北京:人民卫生出版社,2013:65-66.
5 Sibai B,Dekker G,Kupferminc M.Pre- eclampsia.Lancet,2005,365:785-799.
6 Perucci LO,Corrêa MD,Dusse LM,et al.Resolution of inflammation pathways in preeclampsia-a narrative review.Immunol Res,2017,65:774-789.
7 Pavlov VA,Wang H,Czura CJ,et al.The cholinergic anti-inflammatory pathway:a missing link in neuroimmunomodulation.Molecular Medicine,2003,9:125-134.
8 Satyanarayana M.A correlative review of acetylcholine synthesis in relation to histopathology of the human syncytiotrophoblast.Acta Obstet Gynecol Scand,1986,65:567-572.
9 Murthy NV,Melville GN,Wynter HH,et al.In vitro human placental perfusion studies cholinergic activity in normal subjects and in toxaemia of pregnancy.West Indian Med J,1985,34:257-260.
10 Li J,Mathieu SL,Harris R,Ji J,et al.Role of α7 nicotinic acetylcholine receptors in regulating tumor necrosis factor-α (TNF-α) as revealed by subtype selective agonists.Neuroimmunol,2011,239:37-43.
11 Kox M,Pompe JC,Peters E,Vaneker M,et al.α7 nicotinic acetylcholine receptor agonist GTS-21 attenuates ventilator-induced tumor necrosis factor-α production and lung injury.Br J Anaesth,2011; 107:559-566.
12 Hua S,Ek CJ,Mallard C,Johansson ME.Perinatal hypoxia-ischemia reduces alpha 7 nicotinic receptor expression and selective alpha 7 nicotinic receptor stimulation suppresses inflammation and promotes microglial Mox phenotype.Biomed Res Int,2014,2014:718-69.
13 Rita M,Emma G,Rona VD,et al.Nicotinic acetylcholine receptors(nAChR) are increased in the pre-eclamptic placenta.Hypertens Pregnancy,2015,1-14.
14 Hayden MS,Ghosh S.Signaling to NF-KB.Genes Dev,2004,18:2195-2224.
15 Takacs P,Kauma SW,Sholley MM,et al.Increased circulating lipid peroxides in severe preeclampsia activate NF-kappaB and upregulate ICAM-1 in vascular endothelial cells.FASEB J,2001,15:279-281.
16 Dowling O,Rochelson B,Way K,Al-Abed Y,et al.Nicotine inhibits cytokine production by placenta cells via NF-kappaB:potential role in pregnancy-induced hypertension.Mol Med,2007,13:576-83.
17 Raghupathy R.Cytokines as key players in the pathophysiology of preeclampsia.Med Princ Pract,2013,22:18-19.
18 Borzychowski AM,Sargent IL,Redman CW.Inflammation and pre-eclampsia.Serain Fetal Neonatal Mcd,2006,11:309- 316.
19 Liu Y,Yang J,Bao J,et al.Activation of the cholinergic anti-inflammatory pathway by nicotine ameliorates lipopolysaccharide-induced preeclampsia-like symptoms in pregnant rats.Placenta,2017,49:23-32.
Expression of cholinergic anti-inflammatory pathway in Placenta among Preeclampsia patients
ZHENG Linmei,SHI Lei,ZHOU Zhongyi,CHEN Xiaoju,WANG Li,TANG Rong,LU Zhicheng.
570100Department of Obstetrics,Hainan Provincial People′s Hospital
[Abstract]Objective To investigate the expression and its significance of cholinergic anti-inflammatory pathway in placenta of patients with preeclampsia.MethodsmRNA expression and protein of alpha-7 nicotinic acetylcholine receptor (α7nAChR) in placenta was detected by qRT-PCR and Western Blot among 60 women with preeclampsia (including 30 cases of mild preeclampsia and 30 cases of severe preeclampsia) and 30 healthy pregnant women, respectively. Immunohistochemistry was performed to determine the level of activation of nuclear factor-kB (NF-κB) in placentas. ELISA was used to determine cytokine levels, including interleukin 6 (IL-6) and tumor necrosis factor α (TNF-α).Results①The expression of α7nAChR mRNA in placenta was increased significantly with preeclampsia compare to control group and mild preeclampsia group (P<0.01), it was lower in severe preeclampsia than that in control group (P<0.05). Results of Western blotting assay were consistent with these of qRT-PCR. ② The expression of NF-κB protein in placenta was decreased significantly with preeclampsia compare to control group (P<0.05), and there was a significant increase of NF-κB protein expression in severe preeclampsia group when compare to mild group in placenta (P<0.05). ③ The expression of IL-6 and TNF-α proteins in placenta were increased significantly among preeclampsia patients compare to control group (P<0.05). There were higher in patients with severe preeclampsia than those with mild preeclampsia (P<0.05).ConclusionIt suggests that abnormal expression of α7nAChR and NF-κB and excessive pro-inflammatory cytokines in placenta may be related to preeclampsia. Cholinergic anti-inflammatory pathway may play an important role in the pathogenesis of preeclampsia.
[Key words]Preeclampsia; cholinergic anti-inflammatory pathway; α7nAChR; NF-κB
通讯作者:施蕾(13198907396@163.com)
作者单位:570100 海口,海南省人民医院产科
基金项目:海南省自然科学基金项目(810327)
(收稿日期:2018-05-10)
![]()






