子宫内膜癌(Endometrial cancer)是最常见的妇科恶性肿瘤之一,由于在疾病早期即可表现出异常子宫出血等症状,加上近年来子宫内膜癌筛查的普及,超过70%的病例诊断时为早期(FIGO 2009年分期I期及II期)[1]。早期患者以手术治疗为主,合并高危因素的患者往往预后差,对于这部分患者的术后辅助治疗一直存在争议。术后放疗应用最为广泛,但放疗并发症多,多为不可逆的,且近年来有研究提示,对于早期高危子宫内膜癌患者,放疗虽然可以降低局部复发率,但对于降低远处转移率及提高总体生存率无明显作用[2-4]。术后化疗的文献报道较少,有学者对早期高危患者使用术后化疗的疗效进行了研究[5-7],发现术后化疗的并发症多为暂时性的,对患者后续的生存质量影响较小。本课题组曾对106例早期子宫内膜癌患者进行了术后化疗的回顾性研究[8],本研究在此基础上,扩充了病例数量,试图进一步探讨术后辅助化疗的作用。
资料与方法
一、研究人群及基本资料
研究对象选取2004年2月1日至2015年1月31日在北京大学第一医院妇产科初次行手术治疗、术前未行辅助治疗、术后诊断为早期(FIGO 2009年分期I期及II期)且有随访结果的子宫内膜癌病例共434例。其中病理类型为子宫内膜样癌(endometrioid carcinoma,EC)380例(87.6%),非子宫内膜样癌(non-endometrioid carcinoma,NEC)54例(12.4%),其中浆液性乳头状癌36例(66.7%)、透明细胞癌(18例,33.3%)。患者年龄27~81岁,平均(55.7±9.9)岁,未绝经158例(36.4%),已绝经276例(63.6%),已绝经患者的绝经时间为5~31年,平均绝经时间为(10.7±7.4)年。合并高血压者162例(37.3%),合并糖尿病者87例(20.0%)。
二、研究方法
1.手术治疗:所有患者均首先采用手术治疗。术前评估为I期者,行筋膜外全子宫切除+双附件切除术;术前评估为II期者,行次广泛或广泛全子宫切除+双附件切除术。对术前或术中发现有高危因素者行盆腔淋巴结及腹主动脉旁淋巴结切除术,对于有高危因素但肥胖、合并症多,考虑手术困难、手术风险高者,未行淋巴结切除术或仅行淋巴结活检术。
2.病理分期标准:术后分期采用2009年国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)推荐的子宫内膜癌手术-病理分期标准。I期患者413例,占全部患者的95.2%,其中Ia期患者346例(83.8%),Ib期患者67例(16.2%);II期患者21例,占全部患者的4.8%。病理分级为高-中分化者349例(80.4%),低分化者85例(19.6%)。
3.分组:根据有无高危因素将患者分为高危组和低危组。高危因素包括:非子宫内膜样腺癌,组织低分化,深肌层浸润,宫颈间质受累,淋巴脉管间隙受累。含至少一项高危因素者为高危组,共169例(38.9%),无高危因素者为低危组,共265例(61.1%)。
对于高危组推荐术后行辅助化疗,但部分病例因经济困难、有内科合并症、不适宜化疗、恐惧化疗、家属希望对患者病情保密等原因签署知情同意书后未行化疗57例(33.7%)为高危未化疗组,高危组术后行辅助化疗者112例(66.3%)为高危化疗组。对于低危组不推荐术后行辅助化疗,但部分病例因担心疾病复发、转移等原因签署知情同意书后行化疗,低危组术后行化疗者21例(7.9%)为低危化疗组,其余244例(92.1%)为低危未化疗组。
化疗方案为TP方案(紫杉醇+顺铂)或TC方案(紫杉醇+卡铂),药物剂量为紫杉醇135 mg/m2,顺铂70 mg/m2。卡铂按公式计算:卡铂(mg)=AUC(mg/ml/min)×[肌酐清除率(ml/min)+25],其中曲线下面积(Area under the curve,AUC)取值5~6。部分患者术后行内分泌治疗,共44例(9.3%),方案剂量为甲羟孕酮250 mg口服,每日1次,连用3~6个月。所有患者术后均未行放疗。
4.随访:电话随访及门诊复诊随访,随访截止日期2019年1月31日,有随访结果者434例,随访率91.7%(全部患者473例),随访时间3~177月,平均随访时间53.4月。其中因子宫内膜癌死亡者14例(3.2%),死亡时间3~79月,平均死亡时间32.9月。
5.统计学方法:采用SPSS 22.0软件进行统计分析。计数资料采用卡方或Fisher精确概率法检验;采用Kaplan-Meier法计算患者无病生存率,两组之间的比较采用Log-rank检验;无病生存率的相关因素因素分析采用Cox回归法。P<0.05为差异有统计学意义。
结 果
一、早期子宫内膜癌患者高危化疗组与高危未化疗组比较
早期高危子宫内膜癌术后行辅助化疗者112例,未行辅助化疗者57例,对比两组临床资料,发现高危化疗组与高危未化疗组在年龄、合并高血压、合并糖尿病、术前血清CA125升高、淋巴血管间隙阳性、腹水细胞学阳性、深肌层浸润、宫颈间质受累、病理分化程度、病理类型、淋巴结切除等方面均无显著性差异。见表1。
表1 早期子宫内膜癌术后高危化疗组与高危未化疗组资料比较 [例(%)]
Table 1 Baseline characteristics of the patients with and without adjuvant chemotherapy in the high-risk group [n(%)]
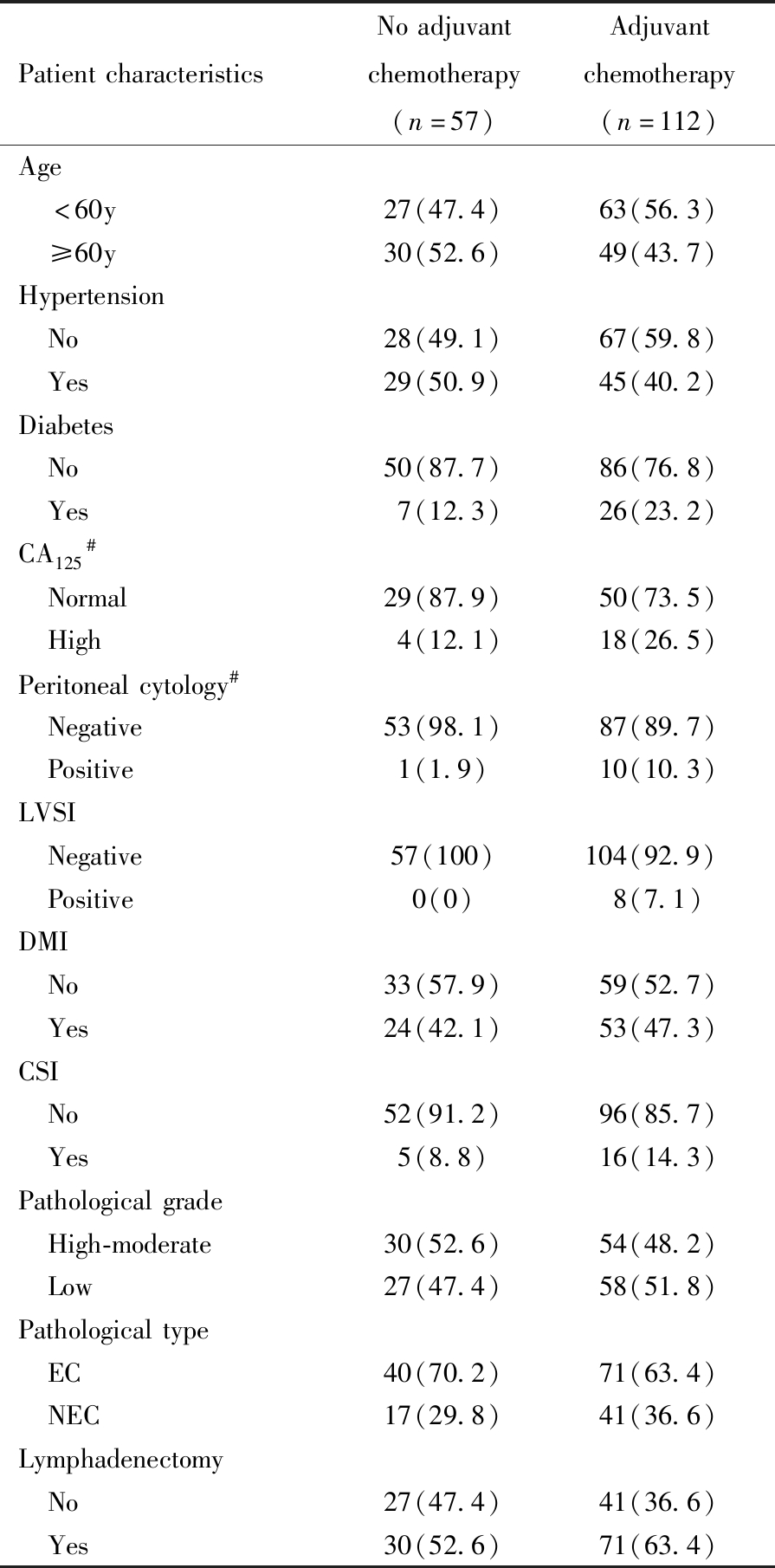
PatientcharacteristicsNoadjuvantchemotherapy(n=57)Adjuvantchemotherapy(n=112)Age <60y27(47.4)63(56.3) ≥60y30(52.6)49(43.7)Hypertension No28(49.1)67(59.8) Yes29(50.9)45(40.2)Diabetes No50(87.7)86(76.8) Yes7(12.3)26(23.2)CA125# Normal29(87.9)50(73.5) High4(12.1)18(26.5)Peritonealcytology# Negative53(98.1)87(89.7) Positive1(1.9)10(10.3)LVSI Negative57(100)104(92.9) Positive0(0)8(7.1)DMI No33(57.9)59(52.7) Yes24(42.1)53(47.3)CSI No52(91.2)96(85.7) Yes5(8.8)16(14.3)Pathologicalgrade High-moderate30(52.6)54(48.2) Low27(47.4)58(51.8)Pathologicaltype EC40(70.2)71(63.4) NEC17(29.8)41(36.6)Lymphadenectomy No27(47.4)41(36.6) Yes30(52.6)71(63.4)
LVSI:lymph-vascular space involvement;DMI:deep(≥1/2) myometrial invasion;CSI:cervical stroma involvement;EC:endometrioid carcinoma;NEC:non-endometrioid carcinoma;#:not all cases were examined.
二、术后辅助化疗对早期高危子宫内膜癌患者生存情况的影响
1.高危化疗组与高危未化疗组生存情况比较
高危化疗组和高危未化疗组5年生存率分别为95%和84%,经Log-rank检验,高危化疗组生存时间长于高危未化疗组,差异有统计学意义(χ2=6.245,P=0.011)。见图1。
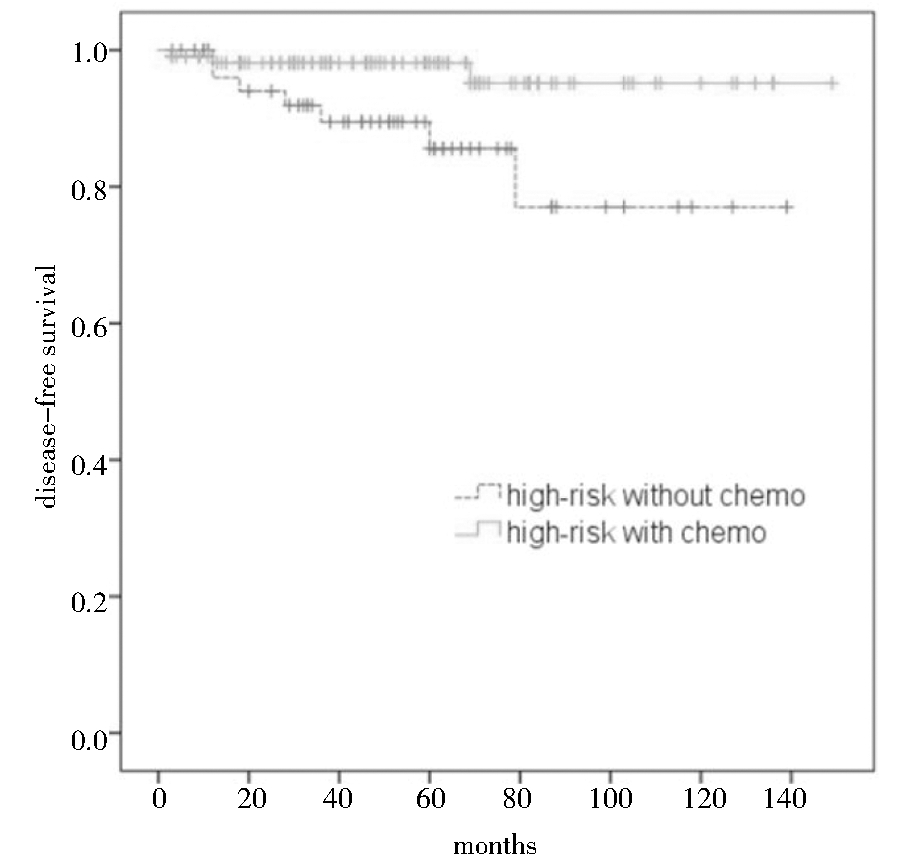
图1 早期子宫内膜患者高危化疗组与高危未化疗组生存曲线图
Figure 1 Kaplan-Meier curves of disease-free survival in the high-risk group patients with and without adjuvant chemotherapy
2.高危未化疗组与低危未化疗组生存情况比较
高危未化疗组和低危未化疗组5年生存率分别为84%和98%,经Log-rank检验,高危未化疗组生存时间短于低危未化疗组,差异有统计学意义(χ2=20.563,P<0.001)。见图2。
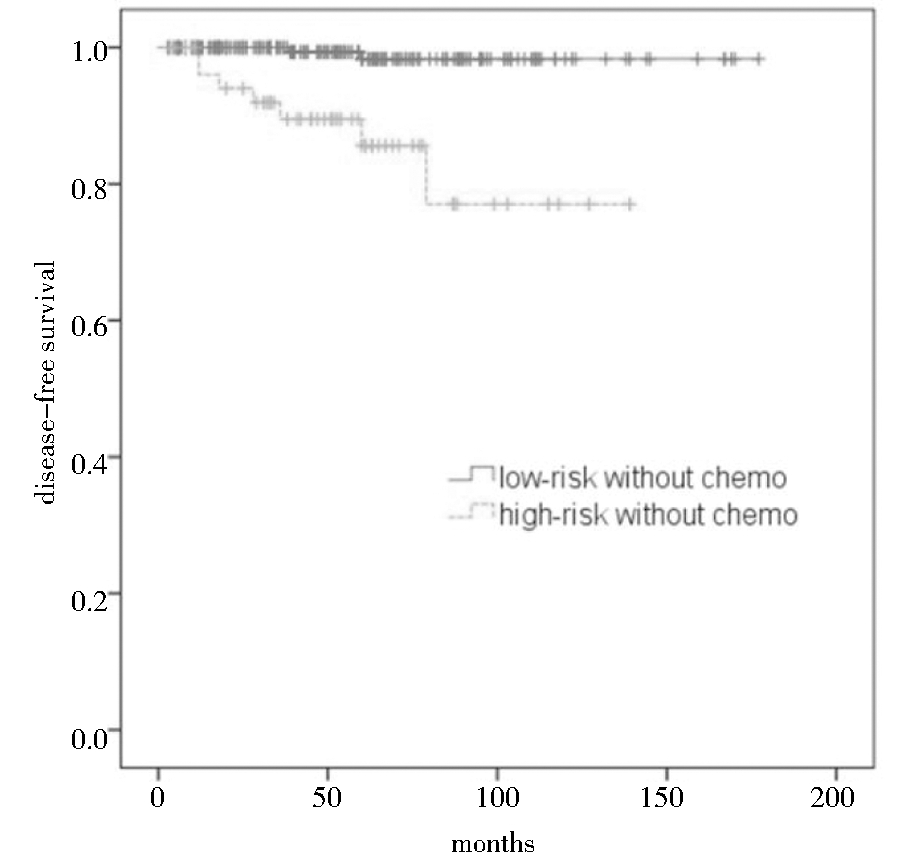
图2 早期子宫内膜癌患者高危未化疗组与低危未化疗组生存曲线图
Figure 2 Kaplan-Meier curves of disease-free survival in the high-risk group and low-risk group patients without adjuvant chemotherapy
3.高危化疗组与低危未化疗组生存情况比较
高危化疗组和低危未化疗组5年生存率分别为95%和98%,采用Kaplan-Meier法进行分析,经Log-rank检验,高危化疗组与低危未化疗组生存时间无显著性差异(χ2=1.922,P=0.166)。见图3。
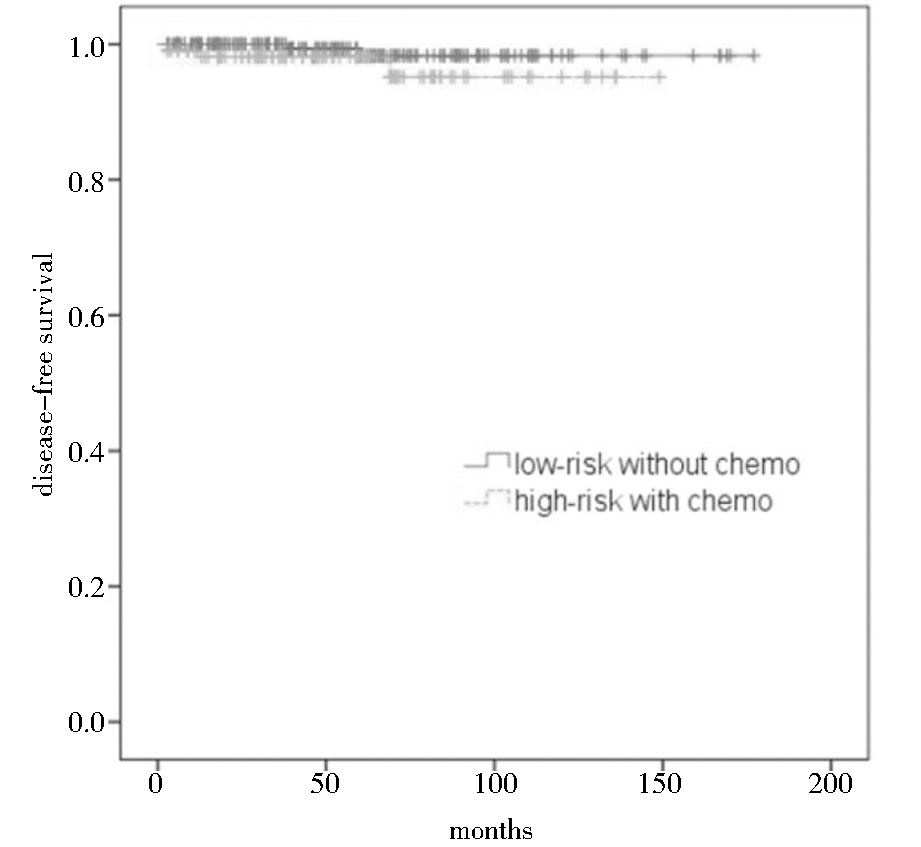
图3 早期子宫内膜癌患者高危化疗组与低危未化疗组生存曲线图
Figure 3 Kaplan-Meier curves of disease-free survival in the high-risk group patients with adjuvant chemotherapy and low-risk group patients without adjuvant chemotherapy
4.化疗疗程对早期高危子宫内膜癌患者生存情况的影响
将高危化疗组112例病例按照化疗疗程分为化疗疗程<4个组41例和化疗疗程≥4个组71例,两组的5年生存率分别为90%和98%,经Log-rank检验,两组生存时间无显著性差异(χ2=1.216,P=0.270)。见图4。

图4 早期高危子宫内膜癌患者化疗疗程<4个组与化疗疗程4个组生存曲线图
Figure 4 Kaplan-Meier curves of disease-free survival in patients with adjuvant chemotherapy <4 cycles and ≥ 4 cycles
5.早期高危子宫内膜癌患者生存情况影响因素分析
经单因素分析发现,术后化疗是早期高危子宫内膜癌患者生存的影响因素(P=0.026),年龄、BMI、组织分化程度、病理类型、深肌层浸润、宫颈间质受累、术前血清CA125升高、腹水细胞学阳性、淋巴结切除等因素对生存情况无显著性影响。将术后化疗、年龄≥60岁、BMI≥28 kg/m2、组织分化程度、手术范围纳入Cox多因素分析,结果显示术后化疗是早期高危子宫内膜癌患者生存的独立影响因素(HR=0.243,95%CI:0.061~0.971,P=0.045),化疗组生存时间更长。见表2。
表2 早期高危子宫内膜癌患者生存情况相关因素分析
Table 2 Survival analysis of patients in the high-risk group
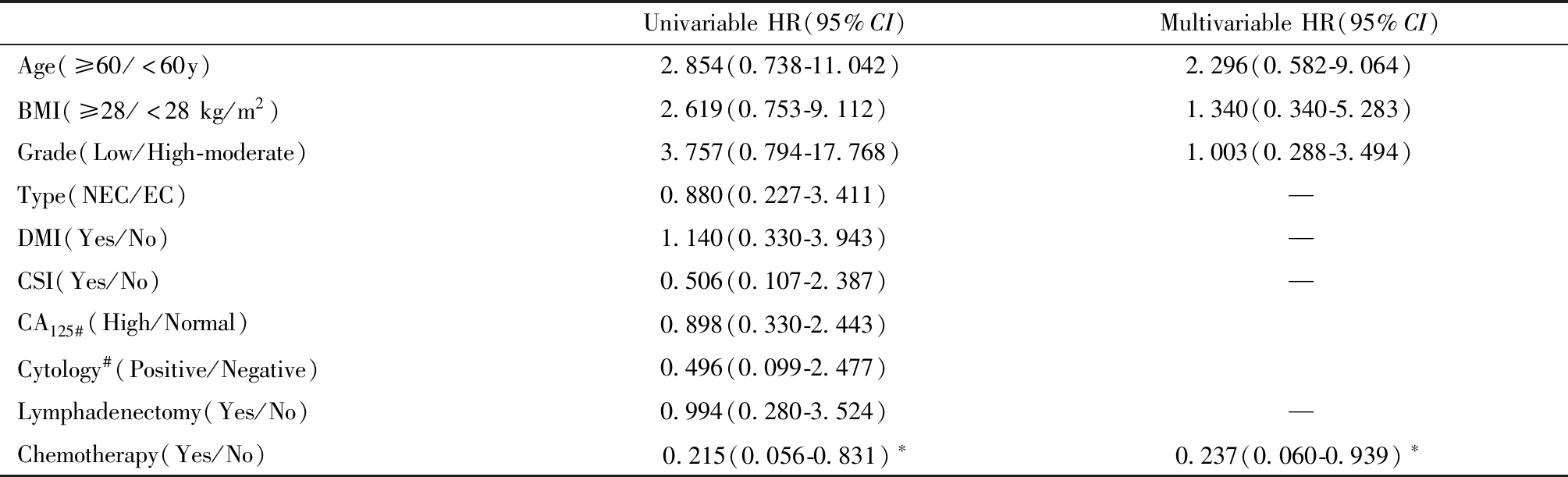
UnivariableHR(95%CI)MultivariableHR(95%CI)Age(≥60/<60y)2.854(0.738-11.042)2.296(0.582-9.064)BMI(≥28/<28kg/m2)2.619(0.753-9.112)1.340(0.340-5.283)Grade(Low/High-moderate)3.757(0.794-17.768)1.003(0.288-3.494)Type(NEC/EC)0.880(0.227-3.411)—DMI(Yes/No)1.140(0.330-3.943)—CSI(Yes/No)0.506(0.107-2.387)—CA125#(High/Normal)0.898(0.330-2.443)Cytology#(Positive/Negative)0.496(0.099-2.477)Lymphadenectomy(Yes/No)0.994(0.280-3.524)—Chemotherapy(Yes/No) 0.215(0.056-0.831)∗0.237(0.060-0.939)∗
EC:endometrioid carcinoma;NEC:non-endometrioid carcinoma;DMI:deep (≥1/2) myometrial invasion;CSI:cervical stroma involvement;#Not all cases were examined,* P<0.05.
讨 论
子宫内膜癌病例超过70%诊断时为早期(I期和II期)[1]。早期患者整体预后较好,但合并高危因素者预后较差。不同研究中对于高危因素的定义不尽相同,目前认为的高危因素包括深肌层浸润、宫颈受累、高危病理类型(透明细胞癌、浆液性乳头状癌及腺鳞癌)、低分化、淋巴血管间隙浸润、高龄、肿瘤大小等[2,9-11]。本研究中高危组患者定义采用FIGO 2015年指南中提出的,含至少一项高危因素(高危病理类型、组织低分化、深肌层浸润、宫颈间质受累及淋巴血管间隙阳性)者定义为高危组,不含高危因素者为低危组[12]。
鉴于无高危因素患者总体预后较好,目前指南不推荐对于这部分患者术后行辅助治疗[13-14]。对于合并高危因素的患者,术后辅助治疗的选择一直有争议,不同指南的推荐有所不同。2018年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中推荐,术后应用辅助化疗的人群包括:(1)子宫内膜样腺癌Ib期、病理为低分化者,术后应用盆腔外放射治疗(External beam radiation therapy,EBRT)和(或)阴道近距离放疗(Vaginal brachytherapy,VBT)±化疗,(2)子宫内膜样腺癌II期、行筋膜外全子宫切除术、病理为低分化者,术后应用EBRT±VBT±化疗,(3)特殊类型子宫内膜癌(浆液性癌、透明细胞癌、未分化/去分化癌、癌肉瘤),如为Ia期,术后首选化疗±VBT,如为Ib期及以上,建议术后行化疗±EBRT±VBT[14]。2018年FIGO指南中仅推荐对于特殊病理类型的早期患者术后进行化疗,在其他早期高危患者中,术后辅助化疗的作用还有待研究 [13]。
早期子宫内膜癌术后辅助治疗最早采用放疗。美国一项纳入56 360名病例的大规模回顾性研究显示,术后补充EBRT或VBT均能够提高I期中高危子宫内膜癌患者的生存率[15]。然而几项大规模随机对照研究及荟萃分析[2-4] 提示,对于早期中高危子宫内膜癌患者,放疗虽然可以降低局部复发率,但对于降低远处转移率及提高总体生存率无明显作用。鉴于术后辅助放疗不能提高早期高危患者总体生存率,多项研究尝试探讨术后辅助化疗是否较放疗更能改善预后,结果显示,早期高危子宫内膜癌患者术后辅助化疗疗效不劣于术后放疗[8,16-18]。也有多项研究对术后行联合放化疗的疗效进行探讨,结果显示联合放化疗较单纯化疗能否进一步改善预后还有争议,且联合治疗副作用更明显[11,19-21]。
在此基础上,有学者提出是否可以单纯行术后辅助化疗,目前已有若干研究提示术后单纯化疗可能改善这部分患者的预后。2002年Hirai等[5]对54例I期子宫内膜癌伴有淋巴血管间隙浸润的患者进行了回顾性分析,31例仅行手术治疗,23例术后行辅助化疗,结果显示,化疗组与未化疗组10年总体生存率分别为89%和56%,化疗组明显高于未化疗组(P=0.02)。Aoki等[6]2004年回顾性分析了170例早期(I期和II期)子宫内膜癌临床病例资料,根据有无高危因素(低分化、深肌层浸润、淋巴血管间隙浸润及宫颈受累)分为高危组和低危组,高危组中26人术后行辅助化疗,8人仅行手术治疗,化疗者5年总体生存率(95.2%∶62.5%)和5年无进展生存率(88.5%∶50.0%)均显著高于未化疗组。在Kodama等[7]2007年的一项研究中,23例Ib-II期低分化子宫内膜病例中,14例术后行辅助化疗,9例未化疗,化疗组5年生存率显著高于未化疗组(92.3%∶50.0%)。本课题组既往研究显示,术后化疗可以改善有高危因素的早期子宫内膜癌患者的预后[8]。本次研究在此基础上扩充了病例数量,结果显示早期高危子宫内膜癌患术后行辅助化疗者预后明显好于未化疗者,高危人群术后行辅助化疗可达到与低危人群相似的预后,提示术后化疗或可抵消高危因素对于早期子宫内膜癌预后的不良影响。多因素分析显示,术后化疗是早期高危子宫内膜癌患者生存的独立影响因素,进一步论证了术后化疗在早期高危子宫内膜癌治疗中的意义。
关于早期高危患者术后辅助化疗的疗程数,本研究提示,疗程≥4个患者生存率大于疗程<4个患者,但差异无统计学意义。目前研究中子宫内膜癌术后辅助化疗疗程多为3~6个疗程[6,17,19]。对于早期卵巢癌,推荐化疗疗程为3~6个[22],而对于早期子宫内膜癌,FIGO指南和NCCN指南均未对化疗疗程数有具体推荐[13-14]。温宏武等[8]提出,化疗疗程≥4个能明显改善早期高危子宫内膜癌患者预后,但病例数量较少,且为回顾性研究。考虑到子宫内膜癌恶性程度低于卵巢癌,对于早期病例可能不需要过多疗程的化疗。未来有待前瞻性随机对照研究进一步探索术后辅助化疗适合的疗程数,在保证疗效的基础上减少不必要的化疗,降低医疗支出,减少化疗副作用。
本研究为回顾性非随机对照研究,病例数量较少,未来有待大规模前瞻性随机对照研究进一步探讨。此外,不同高危因素对于预后可能有不同的影响,对于人群进行亚组细分,探讨各自适合的术后辅助治疗方式,也是未来研究的方向之一。
1 Creasman WT,Odicino F,Maisonneuve P,et al.Carcinoma of the corpus uteri.FIGO 26th Annual Report on the Results of Treatment in Gynecological Cancer.Int J Gynaecol Obstet,2006,95 Suppl 1:S105-143.
2 Keys HM,Roberts JA,Brunetto VL,et al.A phase III trial of surgery with or without adjunctive external pelvic radiation therapy in intermediate risk endometrial adenocarcinoma:a Gynecologic Oncology Group study.Gynecol Oncol,2004,92:744-751.
3 Blake P,Swart AM,Orton J,et al.Adjuvant external beam radiotherapy in the treatment of endometrial cancer (MRC ASTEC and NCIC CTG EN.5 randomised trials):pooled trial results,systematic review,and meta-analysis.Lancet,2009,373:137-146.
4 Kong A,Simera I,Collingwood M,et al.Adjuvant radiotherapy for stage I endometrial cancer:systematic review and meta-analysis.Ann Oncol,2007,18:1595-1604.
5 Hirai M,Hirono M,Oosaki T,et al.Adjuvant chemotherapy in stage I uterine endometrial carcinoma.Int J Gynaecol Obstet,2002,78:37-44.
6 Aoki Y,Watanabe M,Amikura T,et al.Adjuvant chemotherapy as treatment of high-risk stage I and II endometrial cancer.Gynecol Oncol,2004,94:333-339.
7 Kodama J,Seki N,Ojima Y,et al.Efficacy and prognostic implications of administering adjuvant chemotherapy to patients with endometrial cancer that is confined to the uterus.Eur J Obstet Gynecol Reprod Biol,2007,131:76-80.
8 温宏武,田芬,马丽,等.术后化疗对有高危因素的早期子宫内膜癌患者预后的影响.中华妇产科杂志,2009,44:196-199.
9 Nout RA,Smit VT,Putter H,et al.Vaginal brachytherapy versus pelvic external beam radiotherapy for patients with endometrial cancer of high-intermediate risk (PORTEC-2):an open-label,non-inferiority,randomised trial.Lancet,2010,375:816-823.
10 Creutzberg CL,Van Putten WL,Koper PC,et al.Surgery and postoperative radiotherapy versus surgery alone for patients with stage-1 endometrial carcinoma:multicentre randomised trial.Lancet,2000,355:1404-1411.
11 Dd Boer SM,Powell ME,Mileshkin L,et al.Adjuvant chemoradiotherapy versus radiotherapy alone for women with high-risk endometrial cancer (PORTEC-3):final results of an international,open-label,multicentre,randomised,phase 3 trial.Lancet Oncol,2018,19:295-309.
12 Amant F,Mirza MR,Koskas M,et al.Cancer of the corpus uteri.Int J Gynaecol Obstet,2015,131 S2:S96-104.
13 Amant F,Mirza MR,Koskas M,et al.Cancer of the corpus uteri.Int J Gynaecol Obstet,2018,143 S2:37-50.
14 Koh WJ,Abu-rustum NR,Bean S,et al.Uterine Neoplasms,Version 1.2018,NCCN Clinical Practice Guidelines in Oncology.J Natl Compr Canc Netw,2018,16:170-199.
15 Chino JP,Jones E,Berchuck A,et al.The influence of radiation modality and lymph node dissection on survival in early-stage endometrial cancer.Int J Radiat Oncol Biol Phys,2012,82:1872-1879.
16 Maggi R,Lissoni A,Spina F,et al.Adjuvant chemotherapy vs radiotherapy in high-risk endometrial carcinoma:results of a randomised trial.Br J Cancer,2006,95:266-271.
17 Susumu N,Sagae S,Udagawa Y,et al.Randomized phase III trial of pelvic radiotherapy versus cisplatin-based combined chemotherapy in patients with intermediate- and high-risk endometrial cancer:a Japanese Gynecologic Oncology Group study.Gynecol Oncol,2008,108:226-233.
18 施春明.高危早期子宫内膜癌术后辅助放疗与化疗的疗效比较.现代肿瘤医学,2013,21:2066-2068.
19 Kuoppala T,Maenpaa J,Tomas E,et al.Surgically staged high-risk endometrial cancer:randomized study of adjuvant radiotherapy alone vs.sequential chemo-radiotherapy.Gynecologiconcology,2008,110:190-195.
20 Hogberg T,Signorelli M,De Oliveira CF,et al.Sequential adjuvant chemotherapy and radiotherapy in endometrial cancer--results from two randomised studies.Eur J Cancer,2010,46:2422-2431.
21 Park HJ,Nam EJ,Kim S,et al.The benefit of adjuvant chemotherapy combined with postoperative radiotherapy for endometrial cancer:a meta-analysis.Eur J Obstet Gynecol Reprod Biol,2013,170:39-44.
22 Morgan RJ,Armstrong DK,Alvarez RD,et al.Ovarian Cancer,Version 1.2016,NCCN Clinical Practice Guidelines in Oncology.J Natl Compr Canc Netw,2016,14:1134-1163.