病例资料
患儿,女,37+1周顺产娩出,出生体重2 550 g,生后母乳喂养为主,吃奶差、吸吮弱,睡眠多、少哭、少动,生后10 d、18 d因吃奶差、体重不增在门诊给予母乳喂养指导。生后31 d因吃奶量及体重增长不满意,半天来出现呼吸节律异常住院诊治,入院时体重仅2 160 g,嗜睡、反应差,呼吸表浅,呈双吸气样呼吸,四肢肌张力低下。血气分析:PH 7.52,PCO2 11 mmHg,PO2 83 mmHg,BE -11mmol/L,提示呼吸性碱中毒合并代谢性酸中毒,予对症处理后仍持续存在轻度代谢性酸中毒、高乳酸血症。生后43 d患儿开始频繁惊厥,为全身发作,表现为双眼斜视、双上肢上举,强直,持续20秒左右自行缓解,每日发作数十次,发作间期四肢松软。给予地西泮、苯巴比妥抗惊厥治疗后逐渐缓解。尿液有机酸分析显示戊二酸、3-羟基戊二酸、3-甲基戊烯二酸水平增高,头颅B超示双侧丘脑、基底核区域异常回声。惊厥时脑电图提示背景活动成熟延迟,各导尖波发放,初步诊断“戊二酸尿症?代谢病性脑病?”给予维生素B1、B2、B6、辅酶Q10、左卡尼汀、苯巴比妥等对症治疗,惊厥控制后复查脑电图正常,准予出院,门诊随诊。
生后6个月患儿再次出现频繁惊厥,入睡后不久出现双下肢上抬,抱球样发作,成串,每天发作2~3次,最多20余次,脑电图提示背景不典型高度失律,结果见图1。苯巴比妥加量后惊厥发作减轻,仅表现为点头发作,4~5下/串,2~3次/日。生后10个月调整抗癫痫药物,加用妥泰,苯巴比妥减量,未再出现抱球样发作,但出现另一种发作形式:双眼凝视,口唇发绀,四肢屈曲,肌张力高,持续10余秒,1~2次/日,诊断为“癫痫、发育落后、线粒体病?”
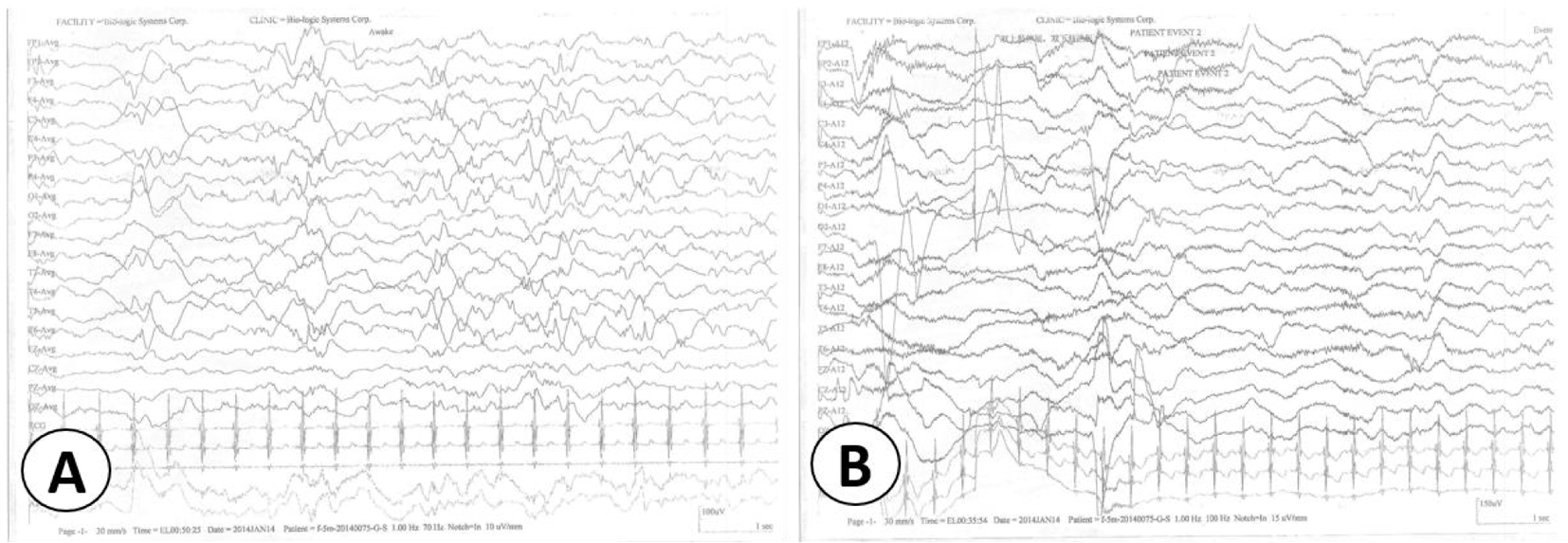
图1 患儿6个月脑电图典型改变
图1A 清醒闭目状态时双侧枕区未见优势节律或活动,呈不典型高度失律(弥漫性不规则慢波、尖慢波夹杂尖波、棘波、多棘波连续发放或散发,异常脑电活动呈杂乱性、非同步、不对称性发放);图1B监测中记录到清醒期有呈串痉挛发作,临床表现为双上肢伸展,双下肢上抬,同期呈全导高波幅双相或三相慢波复合低波幅快波活动发放。
出生史:患儿系第2胎,第1产,胎龄37+1周,出生体重2 550 g,出生身长46 cm,无围产期缺氧窒息史。母孕期合并妊娠期糖尿病,饮食控制血糖。第1胎孕早期因社会因素人工流产。
家族史:父亲32岁,母亲29岁,非近亲婚配,体健,双方均无类似家族病史。
体格检查:头围38 cm,身长68 cm,体重7.5 kg,毛发稀黄,发育落后,营养不良貌。神志清楚,精神萎靡,反应差,全身未见皮疹,未见牛奶咖啡斑及色素脱失斑,皮下脂肪薄。头颅五官无畸形,前囟已闭。心肺及腹部未见异常。四肢肌张力减低,双侧膝腱反射可引出,双侧巴氏征阳性。神经运动发育较同龄儿明显落后,6个月抬头,不追视。
实验室检查:血、尿、便常规未见异常。血糖、血电解质及肾功均正常,生后6个月内谷丙转氨酶(ALT) 63~75 U/L(参考值0~40 U/L),之后恢复正常。肌酶(CK) 30~100 U/L(参考值30~170 U/L),血乳酸4.1~11.5 mmol/L(参考值0.5~2.0 mmol/L),丙酮酸195~ 234 μmol/L(参考值30~100 μmol /L)。血液氨基酸及酯酰肉碱谱:多种氨基酸降低,游离肉碱降低。尿有机酸分析:戊二酸、3-羟基戊二酸浓度增高,乳酸、丙酮酸、3-羟基丙酸、甘油、3-甲基戊烯二酸、3-羟基苯乙酸、2-酮戊二酸浓度增高。可排除典型的氨基酸、脂肪酸和有机酸代谢性疾病,提示营养障碍。头颅核磁共振成像(MRI)及代谢检查:生后1.5个月及6个月时头颅MRI典型表现见图2。头颅MRS提示脑内N-乙酰天门冬氨酸(NAA)峰显著降低,胆碱(Cho)峰异常增高,可见基底节区乳酸峰增高。

图2 患儿头颅核磁典型表现
图2A 生后1.5月,T2FLAIR冠状位显示:双侧大脑半球白质、双侧苍白球T2信号延长。图2B生后1.5月,T2FLAIR矢状位显示:胼胝体T2信号延长。图2C 生后6月,T2冠状位显示:脑萎缩。图2D生后6月,T1矢状位显示:胼胝体萎缩。
线粒体呼吸链酶复合物Ⅰ~Ⅴ活性测定:提取外周血白细胞线粒体蛋白,采用分光光度法测定线粒体呼吸链氧化磷酸化复合物Ⅰ~Ⅴ活性。患儿线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅳ、Ⅴ活性正常,复合物II + III偏低,为70.9%(复合酶活力/内参酶活力×100%)。
线粒体氧化磷酸化途径:均存在缺陷。I通路(复合物Ⅰ+Ⅲ+Ⅳ+Ⅴ)为67.3 nmol/kg/h(正常值>109.7 nmol/kg/h)、II通路(复合物Ⅱ+Ⅲ+Ⅳ+Ⅴ)为47.2 nmol/kg/h(正常值>95.9 nmol/kg/h)、IV通路(复合物Ⅳ+Ⅴ)为78.7 nmol/kg/h(正常值>243.2 nmol/kg/h)。
线粒体基因分析:采用聚合酶链反应-限制性片段长度多态性分析方法(PCR-RFLP)进行外周血白细胞及尿液肾脏脱落细胞的线粒体基因3243A>G、8993T>G、8993T>C和8344A>G突变筛查结果见表1,图3。
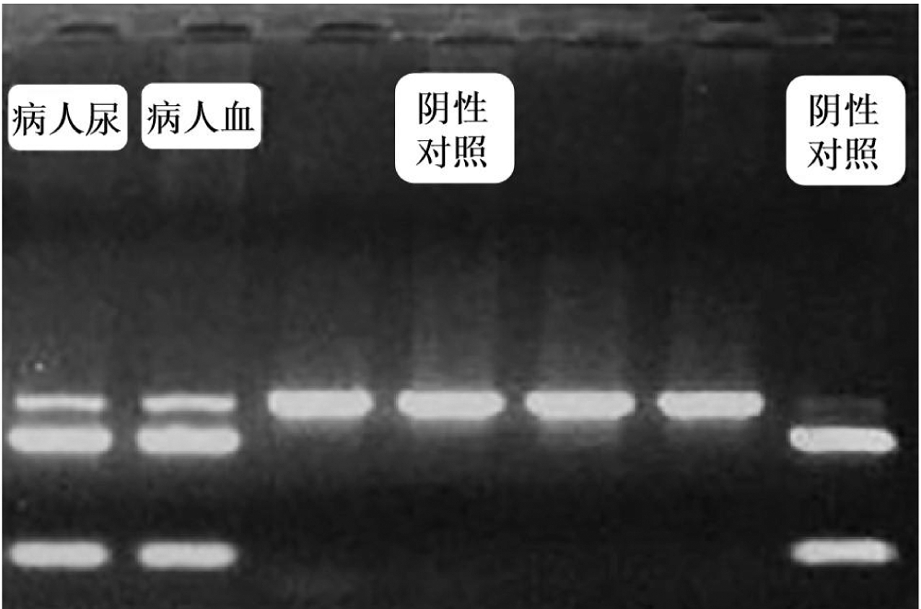
图3 聚合酶链反应-限制性片段长度多态性分析结果
表1 患者及父母外周血白细胞及尿液肾脏脱落细胞线粒体基因分析
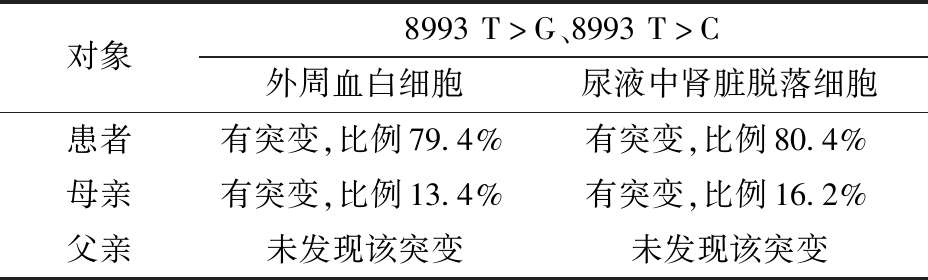
对象8993T>G、8993T>C外周血白细胞尿液中肾脏脱落细胞患者有突变,比例79.4%有突变,比例80.4%母亲有突变,比例13.4%有突变,比例16.2%父亲未发现该突变未发现该突变
诊断、治疗及随访:患儿自新生儿期即出现中枢神经损害和智力运动发育落后,且逐渐进展,伴四肢无力、惊厥、肝损害等多器官损害表现,有血乳酸和丙酮酸升高、代谢性酸中毒,发病早期头颅B超提示基底节区对称性损害,后期头颅MRI表现以脑萎缩为主,尤其胼胝体显著,临床符合Leigh 综合征,父母无类似疾病家族史。外周血白细胞线粒体氧化磷酸化通路测定均存在缺陷,提示存在严重的腺苷三磷酸(ATP)合成障碍,进一步通过线粒体基因分析证实ATP6基因8993T>G、8993 T>C突变导致复合物ATP合成酶缺陷,且尿液中肾脏脱落细胞的突变比例比外周血白细胞还要高,明确诊断为ATP6基因8993T>G突变导致LS。患儿发病后即给予不间断补充B1 300 mg/d;辅酶Q10 30 mg/d;维生素C 100 mg/d。
患儿2岁时随访,体重9.5 kg,全身肌肉无力,自主活动少,拉坐不能竖头,不能言语,抗癫痫治疗效果差,仍有频繁点头样动作,约3~5次/天,睡眠障碍,无进食欲望,每日仅能强迫进食少量配方奶(每天3次,每次150 mL)及少量玉米淀粉糊。
讨论
Leigh综合征(Leigh syndrome,LS) 是由于线粒体呼吸链能量代谢障碍,ATP 生成减少,导致严重神经肌肉损伤,病理表现以脑基底节、脑干、脊髓、小脑等部位的对称性坏死病变为特征,又称亚急性坏死性脑肌病(subacute necrotizing encephalomyelopathy,SNE)。常于婴儿期发病,表现为运动和智力低下、异常呼吸节律、眼震、眼球麻痹、视神经萎缩、共济失调、肌张力障碍,血清中丙酮酸和乳酸含量增高,预后不良。头颅MRI显示病变多累积脑干、基底节、丘脑及第三脑室旁,呈多灶性、双侧对称性分布,T2FlAIR和DWI信号多不均匀,病变同时具有弥散受限和不受限区域[1-3]。新生儿期发病者少见,多存在严重的线粒体呼吸链能量代谢缺陷。1996年Rahman制定的LS诊断标准如下[4]:(1)进行性智力和(或)运动落后;(2)有脑干或基底节损害的症状;(3)血或脑脊液乳酸增高;(4)典型的影像或病理学表现(尸检),或同胞有典型的病理表现。以上前三条加第四条中的任意一点均可以诊断为LS。本例患儿以全身肌张力减低、智力运动发育落后合并难以控制的癫痫发作为主要表现,血乳酸和丙酮酸升高,头颅MRI以对称性的脑萎缩为主,尤其胼胝体部显著萎缩,临床符合LS的诊断。
LS是一种罕见的常染色体隐性遗传性线粒体脑病,在遗传上具有明显的异质性,遗传方式有常染色体隐性、X-连锁和母系遗传。目前已知涉及3种线粒体基因(MT-ND2,MT-ND3,MT-ND6)的突变,进而影响线粒体呼吸链上的5种酶复合物(Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ)和丙酮酸脱氢酶复合物。其基因型复杂,目前报道的基因突变超过85种[1,5-8]。线粒体呼吸链复合物缺陷患者临床表现体征多样,部分患者由于缺乏特异临床表现和体征,临床诊断困难,需要依赖线粒体氧化磷酸化通路测定或氧化磷酸化酶复合物活性测定及基因诊断[9-11]。本例通过检测线粒体氧化磷酸化通路提示存在缺陷,明确病因为线粒体病,为进一步的基因分析确定了方向。
基因分析是诊断LS的重要方法。现已发现ATP合成酶6(ATPase6)缺陷与LS有关,已报道的ATP6基因突变的患者,主要表现为智力运动发育迟滞、肌张力减退,30%的患者外周神经损伤[12-13]。该基因定位于mtDNA 8527~9207,称为MTATP6,并发现了3种错义突变:T8993G、T8993C、T9176C。其中8993位的碱基置换(T-G和T-C)最为常见[14-15]。尤其是T8993G突变,使156位氨基酸由保守亮氨酸变成精氨酸,引起ATP合成酶跨膜结构区(Fo)的功能受到破坏,使酶活性大幅度降低(至少50%),这使耗能极高的脑组织首先受损坏死。当致病突变比率高于75%时临床表现为典型的LS,常于2岁内死亡[16-17]。而T8993C突变仅改变了ATP合酶中疏水尾部(Fo)的构象,使ATP产量略受影响,故临床表现较轻[18]。本例患儿线粒体基因分析提示其ATP6基因8993T>G、8993 T>C突变,母亲携带同样突变基因,父亲未携带此类突变,证实此患儿的发病是由于ATP6基因8993T>G点突变影响氧化磷酸化酶复合物V的活性,进而导致ATP合成酶6(ATPase6)缺陷所致,系母系遗传。母系遗传的LS(maternally inherited Leigh syndrome,MILS)是LS中的少见类型,在国外报道中约占到LS患者的25%,其中编码ATP6的基因突变占5%~10%[19]。在我国2008年1项针对145例LS患儿的研究中,发现MILS共12例(8.3%),其中2例8993T>G,1例8993T>C[11]。国外Santorelli曾报道在50例LS患儿中有12例存在8993T>G突变,其中2例来自相同家族谱系[15]。本患儿通过线粒体呼吸链酶学活性检测进行诊断,基因诊断进一步验证了诊断结果。患儿基因8993T>G突变比例高达80.4%,线粒体氧化磷酸化通路均存在严重缺陷,两种检测结果相吻合。
药物对症治疗是ATP合成酶6缺陷的常用治疗方法,主要是减少有毒性产物产生、通过旁路传递电子、补充代谢辅酶以及抗氧化。常用药物为辅酶Q10、维生素B1、维生素C等。虽经积极的药物支持治疗,此患儿病情仍在进展,惊厥难以控制,脑萎缩显著,预后不良。目前遗传学方面的治疗仍在研究阶段,随着基因敲除动物模型、细胞模型的建立,基因治疗和细胞疗法有望成为新的有效治疗方法。目前有研究通过腺病毒相关载体(adenovirus associated virus,AAV)介导进行基因疗法取得了一定进展,但尚未应用于临床[20]。因该患儿为母系遗传,可通过细胞核转移疗法,将mtDNA突变人类女性的卵母细胞或受精卵的细胞核转移入摘除了细胞核的正常卵母细胞或受精卵中,从而避免mtDNA的遗传[21]。
1 Gerards M,Sallevelt SC,Smeets HJ.Leigh syndrome:resolving the clinical and genetic heterogeneity paves the way for treatment options.Mol Genet Metab,2016,117:300-312.
2 Bindu PS,Taly AB,Sonam K,et al.Bilateral hypertrophic olivary nucleus degeneration on magnetic resonance imaging in children with Leigh and Leigh-like syndrome.Br J Radiol,2014,87:1034.
3 唐晓璐,吕艳秋,陶晓娟,等.儿童Leigh综合征的脑MRI影像学特征及诊断.医学影像学杂志,2019,29:178-183.
4 Rahman S,Blok RB,Dahl HH,et al.Leigh syndrome:clinical features and biochemical and DNA abnormalities.Ann Neurol,1996,39:343-351.
5 Bénit P,Slama A,Cartault F,et al.Mutant NDUFS3 subunit of mitochondrial complex I causes Leigh syndrome.J Med Genet,2004,41:14-17.
6 Lake NJ,Compton AG,Rahman S,et al.Leigh syndrome:One disorder,more than 75 monogenic causes.Ann Neurol,2016,79:190-203.
7 Rahman J,Noronha A,Thiele I,et al.Leigh map:A novel computational diagnostic resource for mitochondrial disease.Ann Neurol,2017,81:9-16.
8 Bonfante E,Koenig MK,Adejumo RB,et al.The neuroimaging of Leigh syndrome:case series and review of the literature.Pediatr Radiol,2016,46:443-451.
9 Lee JS,Kim H,Lim BC,et al.Leigh syndrome in childhood:neurologic progression and functional outcome.J Clin Neurol,2016,12:181-187.
10 姜玉武,黄奕辉,秦炯,等.儿童Leigh综合征的临床、神经病理及分子遗传学研究.中华儿科杂志,2001,39:330-334.
11 张尧,孙芳,孔庆鹏,等.Leigh综合征患儿核基因和线粒体基因突变的初步分析.临床儿科杂志,2008,26:1021-1025.
12 王丽辉,郑华城,杨花芳,等.儿童Leigh综合征4例临床分析.临床儿科杂志,2016,2:111.
13 马艳艳,吴桐菲,刘玉鹏,等.ATP6 基因8993T〉G 突变导致的单纯线粒体ATP 合成酶缺陷一例.中华儿科杂志,2011,49:557-558.
14 Crimi M,Galbiati S,Moroni I,et al.A missense mutation in the mitochondrial ND5gene associated with a Leigh-MELAS overlap syndrome.Neurology,2003,60:1857-1861.
15 Santorelli FM,Shanske S,Macaya A,et al.The mutation at nt 8993 of mitochondrial DNA is a common cause of Leigh′s syndrome.Ann Neurol,1993,34:827-834.
16 Tatuch Y,Christodoulou J,Feigenbaum A,et al.Eeteroplasmic mtDNA mutation(T→G)at 8993 can cause Leigh disease when the percentage of abnormal mtDNA is high.Am J Hum Genet,1992,50:852-858.
17 Ogawa E,Fushimi T,Ogawa -Tominaga M,et al.Mortality of Japanese patients with Leigh syndrome:Effects of age at onset and genetic diagnosis.J Inherit Metab Dis,2020:1-8.
18 Fujii T,Hattori H ,Higuchi Y,et al.Phenotypic differences between T-C and T-G mutations at nt 8993 of mitochondrial DNA in Leigh syndrome.Pediatr Neurol,1998,17:275-277.
19 Ruhoy IS,Saneto RP.The genetics of Leigh syndrome and its implications for clinical practice and risk management.Appl Clin Genet,2014:221-234.
20 Di Meo I,Marchet S,Lamperit C,et al.AAV9-base gene therapy partially ameliorates the clinical phenotype of a mouse model of Leigh syndrome.Gene Ther,2017,24:661.
21 Craven L,Tuppen HA,Greggains GD,et al.Pronuclear transfer in human embryos to prevent transmission of mitochondrial DNA disease.Nature,2010,465:82-85.