N6-甲基腺嘌呤(m6A)是发生于哺乳动物mRNA上最为常见的修饰[1]。m6A高通量测序结果证实超过7 000个人类基因含有m6A,且每2 000个核苷酸中有一个m6A。m6A修饰主要发生于mRNA高度保守的共识序列:RRACH(R = G or A;H = A,C or U)[2]。研究表明,m6A影响mRNA的剪接、运输、翻译和降解,参与脂肪生成、发育、致癌、干细胞再生以及其他生命进程[2]。
AlkB同源蛋白5(AlkB homologue 5,ALKBH5)是目前发现的m6A去甲基化酶之一,在m6A动态调控过程中起到重要作用[3]。ALKBH5属于AlkB家族蛋白成员,具有保守的铁连接区域和α-酮戊二酸作用区域[4]。研究证实ALKBH5与小鼠的生殖密切相关,ALKBH5敲除小鼠mRNA的m6A水平显著上调,并且小鼠睾丸萎缩,精子数目和活动力的下降[5],但具体发生机制尚不明确。
富含半胱氨酸分泌蛋白2(CRISP2,Cysteine-rich secretory proteins 2)主要存在于哺乳动物雄性生殖系统,且与生殖的不同阶段相关[6]。CRISP2敲除的小鼠精子功能缺陷,导致生殖障碍[7]。β-防御素1(DEFB1,β-defensin 1)广泛分布于机体内,具有抗微生物的活性,抑制DEFB1功能会降低正常精子的活力和杀菌活性[8]。为了探究m6A升高引起的男性弱精症的发病机制,本研究通过敲除和过表达精原细胞(GC-1)的m6A去甲基化酶ALKBH5,检测m6A和精子功能相关基因CRISP2和DEFB1的表达,从而明确m6A去甲基化酶ALKBH5对小鼠精原细胞(GC-1)功能的影响。
材料与方法
1.材料:研究所需的主要试剂和仪器包括DMEM高糖培养基(美国Gibco公司)、0.25% 胰蛋白酶(美国Thermo公司)、胎牛血清(美国Gibco公司)、1%双抗(青霉素、链霉素)(美国Gibco公司)、Lipofectamine 3000 (美国Invitrogen公司)、iTaqTM Universal Supermixes (美国BioRad公司)、ALKBH5抗体(中国Proteintech公司)、GAPDH抗体(中国Proteintech公司)、TRIzol (美国Invitrogen公司)、逆转录试剂盒(日本TOYOBO公司)、核酸酶S1(中国Takara公司)、碱性磷酸酶(中国Takara公司)、磷酸二酯酶(中国Sigma-Aldrich公司)、标准品(rA,rU,rC,rG,dA,T,dC,dG,m6A)(中国Sigma-Aldrich公司);实时荧光定量PCR仪(美国Bio-Rad公司)、低温离心机(美国Beckman公司)、LC-20AD高效液相色谱仪(日本岛津公司)、Hisep C18-T色谱柱 (150 mm×2.1 mm 5 μm,中国韦泰公司)、AB 3200 QTRAP 质谱仪(美国Life Technologie公司)。
2.细胞培养:由本实验室冻存复苏而得的人胚肾细胞HEK293T和小鼠精原细胞(GC-1)于含有10% 胎牛血清和1%双抗DMEM的培养基中,37 ℃、5% CO2进行培养,当细胞生长状态良好并且融合度达到约80% 时,进行细胞传代或继续下列实验。
3.ALKBH5敲除与过表达:利用Lipofectamine 3000将ALKBH5敲除质粒和空载质粒分别与病毒包装质粒共转染HEK293T细胞,48 h后收集含病毒颗粒的细胞培养上清液,浓缩病毒液,用病毒液感染小鼠精原细胞(GC-1),72 h 后加入2 μg/mL 的嘌呤霉素筛选,将筛选出的细胞扩大培养并收样,设置敲除组sh-ALKBH5和对照组sh-CTL;利用Lipofectamine 3000 将质粒pcDNA3.1-ALKBH5与空载pcDNA3.1分别转染至小鼠精原细胞(GC-1),48 h后收集转染的细胞,设置过表达组oe-ALKBH5和对照组oe-CTL。
4.RNA提取与逆转录:TRIzol法提取ALKBH5敲除和过表达细胞RNA,方法参照试剂说明书,40 μL RNase-Free ddH2O溶解沉淀,用NanoDrop检测RNA的浓度与纯度。逆转录试剂盒将细胞RNA逆转录为cDNA,方法参照试剂盒说明书。
5.LC-MS/MS检测细胞m6A水平:利用核酸酶S1、碱性磷酸酶、磷酸二酯酶酶解精子RNA,采用液相色谱与质谱联用系统检测细胞m6A水平。检测方式为多反应监测(multiple reaction monitoring,MRM)模式,监测离子对(母离子→子离子)分别为:m6A(282.2 →150.1),rA(268.4 → 136.2),rU(245.4 → 113.1),rC(244.4 → 112.2),rG(284.5 → 152.2),dA(252.4 → 136.2),T(243.3 → 127.2),dC(228.4 → 112.2),dG(268.4 → 152.4)。
6.qPCR检测精子功能相关基因的表达水平:qPCR仪检测精子功能相关基因(CRISP2和DEFB1)表达水平,利用β-肌动蛋白(β-ACTIN)基因和甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate Dehydrogenase,GAPDH)基因作为内参基因进行标化,引物如下(5′→3′):CRISP2上游引物5′-CGGACATTACACTCAG-3′,下游引物5′-TTGTTACCCATAGGAC-3′,DEFB1上游引物5′-CTTTCTCCTGGTGATG-3′,下游引物5′-GTTCCCTGTAGTTTGG-3′,GAPDH上游引物5′-CAGCAACTCCCACTCTTCCAC-3′,下游引物5′-TGGTCCAGGGTTTCTTACTC-3′,β-ACTIN上游引物5′-GTACGACCAGAGGCATACA-3′,下游引物5′-AGCACCCTGTGCTGCTCA-3′。
7.蛋白提取与Western 印迹:收集ALKBH5敲除和过表达细胞(sh-ALKBH5、sh-CTL、oe-ALKBH5、oe-CTL),加入RIPA裂解液于冰上裂解30 min。离心收集上清液,加入上样缓冲液煮沸,得到细胞总蛋白样品。采用10% SDS-PAGE 分离胶电泳分离细胞总蛋白,转膜,脱脂奶粉室温封闭1 h后,于4 ℃一抗孵育过夜,TBST 洗脱15 min三次,加入二抗室温孵育2 h,TBST 洗脱15 min三次,显影。以GAPDH 作为内参蛋白。
8.统计学分析:所有数据采用SPSS 19.0进行分析,各组数据采用![]() 表示,各组间差异采用t检验,P<0.05表示具有统计学差异。
表示,各组间差异采用t检验,P<0.05表示具有统计学差异。
结果
1.GC-1细胞的ALKBH5敲除及过表达:通过Western 印迹检测ALKBH5敲除和过表达细胞(sh-ALKBH5、sh-CTL、oe-ALKBH5、oe-CTL)的ALKBH5蛋白表达(见图1),sh-ALKBH5组细胞ALKBH5表达显著低于对照组(sh-CTL),oe-ALKBH5组细胞ALKBH5表达显著高于对照组(oe-CTL),表明在GC-1细胞中成功敲除和过表达ALKBH5。

图1 GC-1细胞中敲除和过表达ALKBH5的蛋白表达
2.ALKBH5敲除及过表达细胞m6A含量:LC-MS/MS检测精子RNA的m6A水平,结果表明敲除组sh-ALKBH5的 m6A含量(0.337%±0.011%)明显高于对照组sh-CTL的m6A 含量(0.293%±0.006%),P=0.004(见图2);过表达组oe-ALKBH5细胞m6A含量(0.214%±0.011%)明显低于对照组oe-CTL的m6A 含量(0.256%±0.012%),P=0.028。

图2 ALKBH5敲除及过表达细胞m6A含量
3.ALKBH5敲除及过表达细胞中精子功能相关基因表达:荧光定量PCR检测ALKBH5敲除及过表达细胞中精子功能相关基因CRISP2和DEFB1的表达水平,结果表明敲除ALKBH5,精子功能相关基因CRISP2和DEFB1表达水平下降;过表达ALKBH5,CRISP2和DEFB1表达升高(图3)。
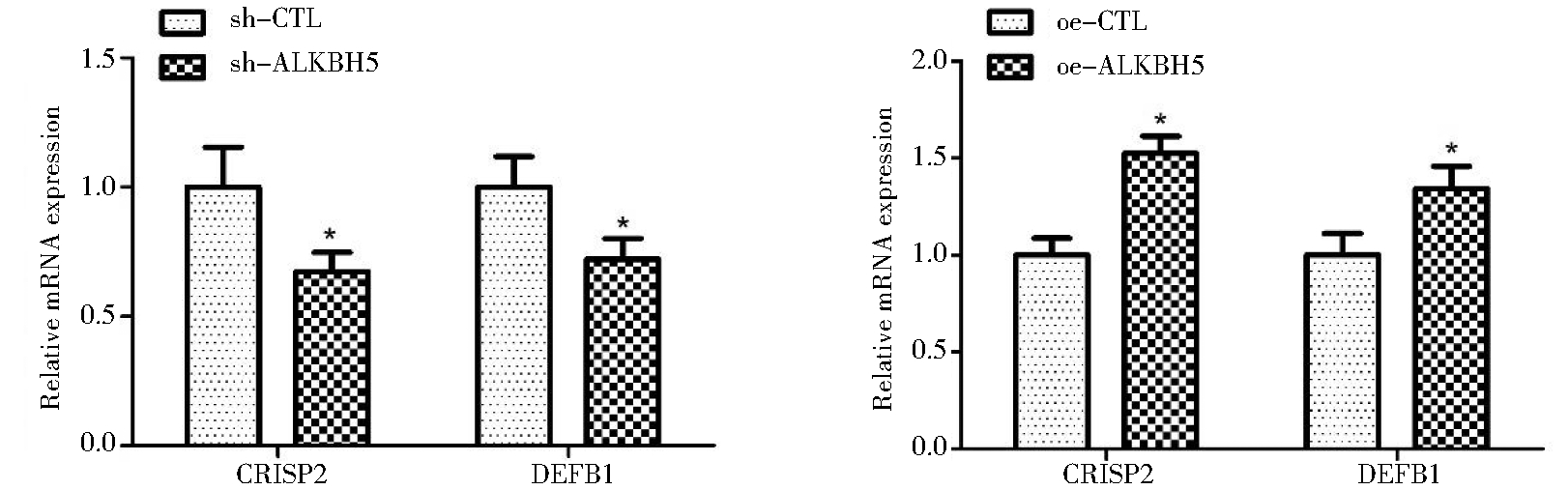
图3 ALKBH5敲除及过表达细胞中精子功能相关基因表达
讨论
m6A是近年来研究比较热门的RNA甲基化修饰,m6A影响mRNA的稳定性和功能,可通过参与mRNA的剪接、转运、加工等过程来影响基因的表达[9]。ALKBH5是具有RNA去甲基化活性的AlkB家族蛋白,在人类细胞系中敲除ALKBH5,不仅会导致总RNA的m6A含量升高,还会促进这些RNA从细胞核向细胞质的运输。此外,ALKBH5还影响RNA的初期合成和剪接效率[9]。本研究敲除和过表达精原细胞(GC-1)的m6A去甲基化酶ALKBH5,敲除ALKBH5导致m6A水平升高,过表达ALKBH5导致m6A水平降低。由此可见,ALKBH5作为m6A去甲基化酶,在调控GC-1细胞m6A过程中起到重要作用。随后本实验检测了敲减和过表达ALKBH5的精原细胞精子功能相关基因CRISP2和DEFB1的mRNA表达水平,发现ALKBH5抑制CRISP2和DEFB1基因的表达,其可能的机制是ALKBH5促进m6A的去甲基化,从而影响CRISP2和DEFB1基因的稳定表达。
CRISP2是不育相关基因中的潜在候选基因,在弱精子症病人精子中,CRISP2蛋白水平降低,且CRISP2表达的降低与低精子活动度和不正常的精子形态具有相关性[7]。CRISP2敲除小鼠的精子受精能力和Ca2+调控缺陷导致了小鼠的生殖缺陷[7]。DEFB1是首个被证实的β-defensin 家族成员,在不育男性精子中,DEFB1的含量是明显低于正常精子的,且与精子活动度和抗菌活性降低密切相关。DEFB1与趋化因子受体6(chemokine receptor type 6,CCR6)相互作用,促发对精子运动具有重要作用的Ca2+动员,因此在活力异常的男性不育患者中,DEFB1可能具有诊断和治疗潜能[8]。本研究在细胞水平验证了ALKBH5调控的m6A改变会引起CRISP2和DEFB1表达改变,而CRISP2和DEFB1对精子的功能具有重要影响,由此可以推断,m6A去甲基化酶ALKBH5通过影响CRISP2和DEFB1的表达,而影响精子的功能,这可能也是弱精症精子活动度降低的原因之一。
综上所述,本研究通过在小鼠精原细胞GC-1中干扰和过表达ALKBH5,探究ALKBH5调控的m6A修饰对精子功能相关基因的影响,为弱精子症发病机制的研究提供依据,对男性不育的研究具有一定的意义。
1 Zhou J,Wan J,Shu XE,et al.N(6)-methyladenosine guides mrna alternative translation during integrated stress response.Mol Cell,2018,69:636-647,e637.
2 Zhao BS,Roundtree IA,He C.Post-transcriptional gene regulation by mrna modifications.Nat Rev Mol Cell Biol,2017,18:31-42.
3 Zhang C,Samanta D,Lu H,et al.Hypoxia induces the breast cancer stem cell phenotype by hif-dependent and alkbh5-mediated m(6)a-demethylation of nanog mrna.Proc Natl Acad Sci U S A,2016,113:E2047-2056.
4 Thalhammer A,Bencokova Z,Poole R,et al.Human alkb homologue 5 is a nuclear 2-oxoglutarate dependent oxygenase and a direct target of hypoxia-inducible factor 1alpha (hif-1alpha).PLoS One,2011,6:e16210.
5 Zheng G,Dahl JA,Niu Y,et al.Alkbh5 is a mammalian rna demethylase that impacts rna metabolism and mouse fertility.Mol Cell,2013,49:18-29.
6 Anklesaria JH,Kulkarni BJ,Pathak BR,et al.Identification of crisp2 from human sperm as psp94-binding protein and generation of crisp2-specific anti-peptide antibodies.J Pept Sci,2016,22:383-390.
7 Brukman NG,Miyata H,Torres P,et al.Fertilization defects in sperm from cysteine-rich secretory protein 2 (crisp2) knockout mice:Implications for fertility disorders.Mol Hum Reprod,2016,22:240-251.
8 Diao R,Fok KL,Chen H,et al.Deficient human beta-defensin 1 underlies male infertility associated with poor sperm motility and genital tract infection.Sci Transl Med,2014,6:249ra108.
9 Fu Y,Dominissini D,Rechavi G,et al.Gene expression regulation mediated through reversible m(6)a rna methylation.Nat Rev Genet,2014,15:293-306.