子痫前期是妊娠20周后出现高血压伴有蛋白尿的一类胎盘源性疾病,全球发病率高达2%~8%,每年可造成至少4.2万名孕产妇死亡[1-3]。子痫前期不仅可引起早产、低出生体重甚至死产等不良围产期结局,也可造成子代心血管结构损伤、神经系统认知功能障碍以及代谢失调等远期影响[4]。中国子痫前期发病呈现重度亚型占比大,死产率高且逐年上升的特点[5-6]。目前,子痫前期发病机制尚不清晰,缺乏有效的临床防治措施,给围产期的母婴健康造成了极大威胁。
代谢组学是系统生物学的重要分支,它可对生物样本中的小分子代谢物进行定性或者定量分析,并利用生物信息学技术识别其参与的生理病理过程。该方法近几年已被广泛用于疾病发病机制探索、生物标志物和药物治疗靶点筛选以及疾病模型预测等相关研究[7-8]。子痫前期是一种源于胎盘结构和功能发育障碍的妊娠期疾病,病因和发病机制复杂,明确胎盘代谢物的变化情况对于理解子痫前期发病具有重要意义。到目前为止,基于代谢组学研究子痫前期的生物样本多为血浆和血清[9-13],而关于胎盘代谢谱的变化研究有限,并且样本取材阶段、检测手段、差异代谢物的种类和含量均不一致[12-13],不能为子痫前期这一胎盘源性疾病的发病机制探讨提供充足的证据。
非靶向代谢组学方法可以对生物样本中的内源性代谢产物进行系统全面地相对定量检测,是后续靶向代谢物作用研究的前提依据。本研究构建脂多糖诱导的子痫前期模型小鼠,采用超高效液相色谱-质谱联用(UPLC-MS/MS)技术非靶向检测胎盘代谢谱,筛选潜在的差异代谢物和代谢通路,为系统研究胎盘代谢物提供重要参考,更好地阐释子痫前期发病机制。
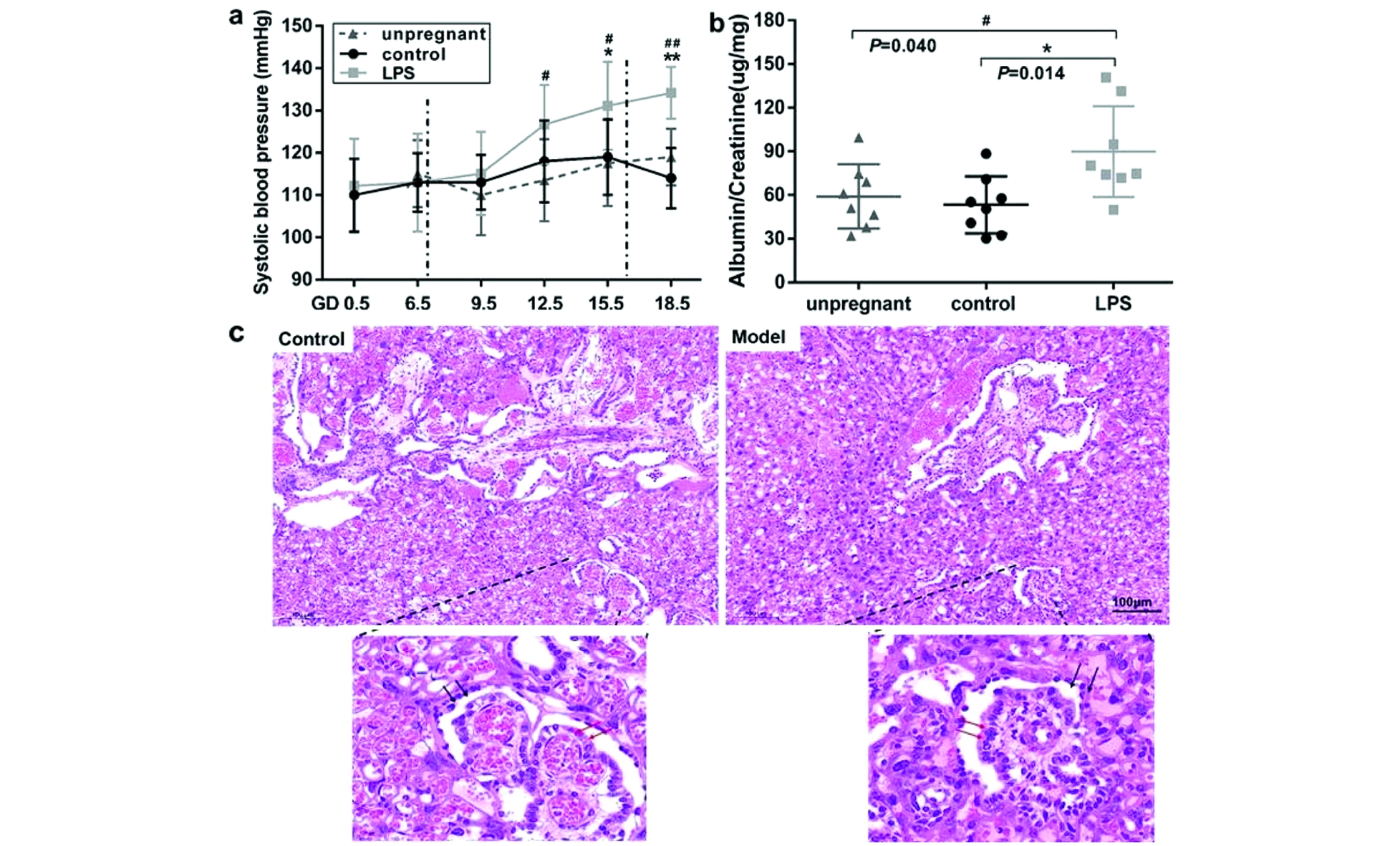
(a) Changes of systolic blood pressure of pregnant mice in the control group (n=8), model group (n=11), and female mice in unpregnant group (n=8), respectively. (b) The 24 h albumin/creatinine was compared among the different groups. (c) HE staining was used to examine the pathological changes of placenta. *Model vs. Control; #Model vs. Unpregnant.
图1 脂多糖诱导孕鼠的子痫前期样表型
Figure 1 The preeclampsia-like phenotype in pregnant mice induced by lipopolysaccharide
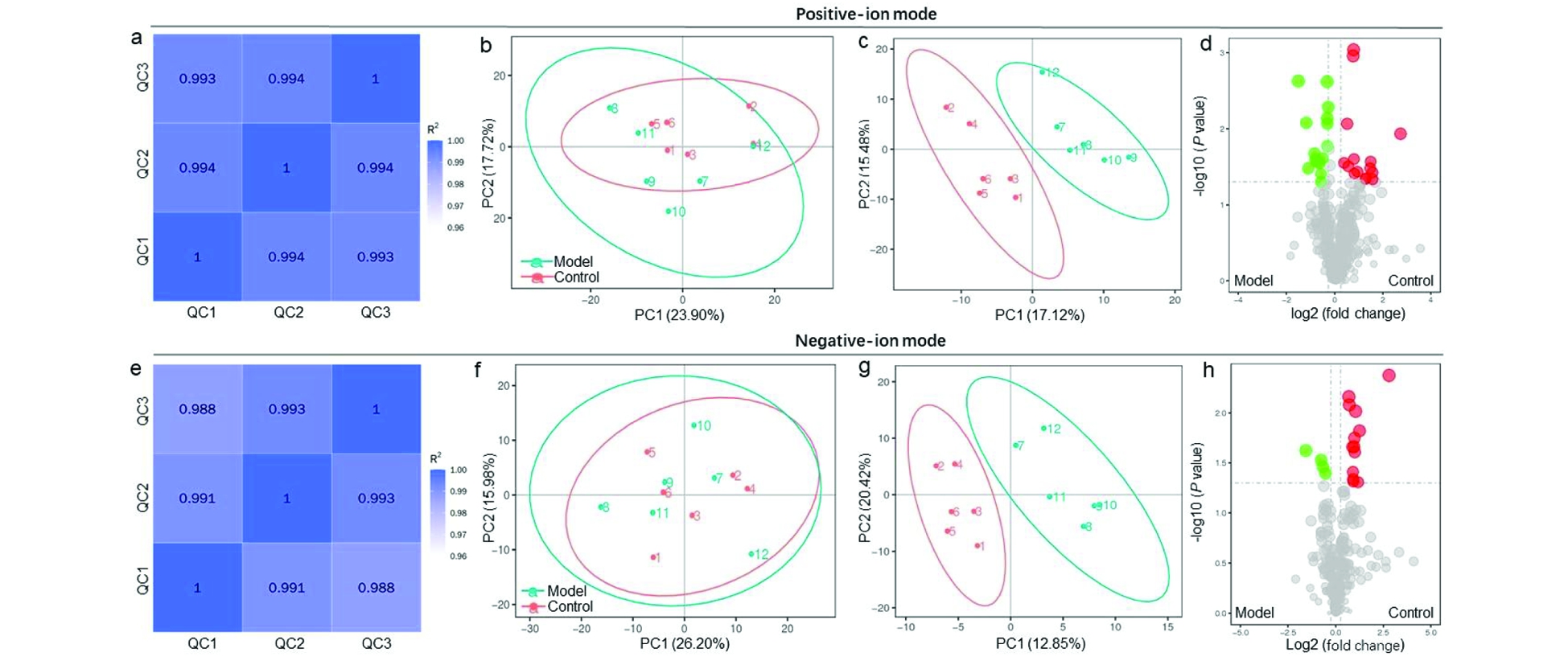
Pearson coefficients of QC samples were calculated based on peak area (a and e). The distribution of samples inthe control and model groups was showed by PCA (b and f) and PLS-DA (c and g) analysis. Volcano plot was used to show the differential metabolites between the control group and model group (d and h).
图2 采用UPLC-MS/MS技术分别在正和负离子模式下检测胎盘代谢物
Figure 2 Placental metabolites were detected by UPLC-MS/MS in both positive- and negative-ion modes, respectively
材料与方法
一、仪器和材料
1.主要仪器:UHPLC超高液相色谱仪(Thermo Fisher, 德国)、Q ExactiveTM HF质谱仪(Thermo Fisher, 德国)、色谱柱(Thermo Fisher, 美国)、低温离心机(Scilogex,美国)、光学显微镜(Nikon,日本)、酶标仪(Tecan,瑞士)、切片机以及振荡器等。
2. 主要试剂:脂多糖(Sigma,美国)、甲醇(Thermo Fisher,美国)、甲酸(Thermo Fisher,美国)、醋酸铵(Thermo Fisher,美国)、LC-MS级水(Merck,德国)、尿蛋白和肌酐试剂盒(南京建成生物科技有限公司)、4%多聚甲醛溶液、苏木精染液、伊红染液以及无水乙醇等。
二、动物模型构建
选用7~8周性成熟的健康ICR小鼠(25±3)g,购买自北京大学医学部实验动物科学部,在SPF级动物室适应性喂养一周后进行交配,温度为(23±2)℃,相对湿度为(55±5)%,昼夜交替为12 h,次日在阴道内查到阴栓定义为孕第0.5天(gestational day 0.5, GD 0.5)。将孕鼠随机分为对照组(8只)和子痫前期模型组(13只),于孕中晚期GD 7.5~GD 17.5每天分别腹腔注射生理盐水和20 μg/kg剂量的脂多糖,观察终点为GD 18.5。另设置非孕组,选择8只同等月龄的ICR未孕雌鼠,连续11 d每天腹腔注射20 μg/kg剂量的脂多糖[14]。动物实验已获得北京大学生物医学伦理委员会批准(LA2022196)。
三、动物实验数据和样本收集
待小鼠安静后,采用无创尾压法测量各组小鼠的收缩压,每只小鼠测量三次,并保证每次之间的差别在10 mmHg以内,取三次测量的平均值作为该小鼠的收缩压。各组小鼠在最后一次暴露脂多糖后放入代谢笼内,禁食不禁水,收集24 h尿液,经3 000 rmp离心10 min后取上清,采用试剂盒测量尿蛋白和肌酐含量并计算24 h尿蛋白/肌酐比值。在观察终点,记录对照组和模型组孕鼠的流产、吸收胎、死胎和活产胎仔数量,以及胎仔重量,取新鲜胎盘组织保存于-80℃待测。
四、检查胎盘组织结构
每组取2只孕鼠的胎盘组织采用4%多聚甲醛溶液固定,经过脱水、透明和包埋处理后纵向切成5 μm左右的切片,将脱蜡后的切片进行苏木精-伊红(HE)染色,封片后置于光学显微镜下观察胎盘结构变化并拍照。
五、超高效液相色谱-质谱联用非靶向检测胎盘代谢物
1.样本处理:每组随机选择6只孕鼠,精密称量100 mg液氮研磨的胎盘组织匀浆,加入80%甲醇溶液,静置5 min后15 000 g、4℃离心20 min,使用LC-MS级水稀释甲醇后再次离心,取上清进样检测。另外,从每个样品中取等体积混匀制备质控(QC)样品,在实验样本进样前、中和后均上机检测以保证实验过程中的系统稳定性。
2.色谱条件:(1)色谱柱Hypesil Gold column (C18);(2)正模式。流动相A(0.1%甲酸),流动相B(甲醇);(3)负模式。流动相A(5 mM 醋酸铵,pH 9.0),流动相B(甲醇);(4)流速0.2 mL/min;(5)柱温40℃。
3.质谱条件:(1)电喷雾离子源设置。喷雾电压为3.5 kV,鞘气流速为35 psi (1 psi=6.895 kPa),辅助气流速为10 L/min,离子传输管温度为320°C,离子导入射频电平为60,辅助气加热器温度为350°C,极性为positive和negative,扫描范围选择m/z 100~1500 Da。(2)二级质谱采用数据依赖性扫描。
六、数据处理与统计分析
应用CD3.1软件对原始数据进行色谱峰识别、校正和标准化处理。使用HMDB数据库和LIPIDMaps数据库对鉴定到的代谢物进行注释。基于代谢物的相对定量值计算QC样本之间的Perarson相关系数,以指示检测系统的稳定性。应用metaX软件对代谢组学数据转换后进行主成分分析(PCA)和偏最小二乘法判别分析(PLS-DA),应用R软件绘制代谢物火山图。计算代谢物在模型组相比于对照组的差异倍数(FC)和变量权重值(VIP),并采用Student′s t检验得到两组间代谢物的含量差异,设定P<0.05且VIP>1筛选差异代谢物。使用KEGG 数据库对代谢物进行功能注释,得到显著富集的代谢通路(P<0.05)。
七、文献检索
以“子痫前期”“代谢组学”“小鼠”“大鼠”作为主题词检索PubMed、Scopus和Web of Science数据库公开发表的文献,检索时间至2022年10月10日。英文检索词为preeclampsia、metabonomic*、metabolomic*、metabolite* profil*、metabolomic profil*、mice、mouse、KM、ICR、BALB/c、C57BL*、rat、SD和Wister。结果共检索到47篇文献(PubMed 8篇,Scopus 19篇,Web of Science 20篇),去掉重复后剩余33篇进行摘要和全文阅读,最终纳入5篇文献进行信息摘录。
结 果
一、脂多糖诱导孕鼠子痫前期样表型
相比于对照组,模型组孕鼠发生流产、死产胎和吸收胎的数量增加,平均每窝胎鼠的数量为(8.3±2.4)只,出生体重为(1.2±0.1)g,较对照组分别降低了39.4%(P<0.01)和17.2%(P<0.01)(表1)。模型组孕鼠的收缩压在脂多糖处理后有所增加,在孕第12.5、15.5和18.5天,模型组的收缩压较对照组分别升高了8.4 mmHg(P>0.05)、12.1 mmHg(P<0.05)和20.2 mmHg(P<0.01)(图1a);同时,24 h尿蛋白/肌酐比值显著增加(P<0.01)(图1b),而非孕组的相关指标与对照组之间无明显差异。说明本研究采用脂多糖暴露诱导孕鼠出现的不良妊娠结局、血压升高伴有蛋白尿的子痫前期样表型具有妊娠期特异性。H&E染色结果显示模型组的胎盘结构相比于对照组出现明显异常,绒毛发育不良,血管数量减少且官腔变窄,滋养层细胞排列紊乱,数量有一定的减少(图1c)。
表1 脂多糖诱导子痫前期孕鼠的不良妊娠结局
Table 1 The adverse pregnancy outcomes of mice with preeclampsia-like phenotype induced by lipopolysaccharide
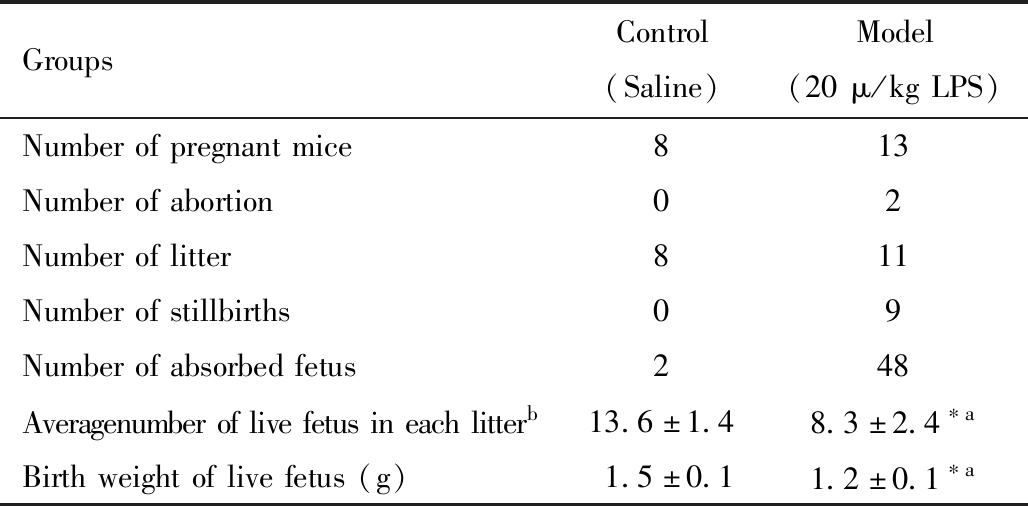
GroupsControl(Saline)Model(20μ/kgLPS)Numberofpregnantmice813Numberofabortion02Numberoflitter811Numberofstillbirths09Numberofabsorbedfetus248Averagenumberoflivefetusineachlitterb13.6±1.48.3±2.4∗aBirthweightoflivefetus(g)1.5±0.11.2±0.1∗a
aP value <0.01 of t-test between the control group and model group; bAverage number of live fetus in each litter = total number of live fetus / the number of litter; Model vs. Control,*P<0.05
二、代谢图谱多元分析
胎盘组织经UPLC-MS/MS技术分别在正、负模式下进行数据采集,为获得数据质量高且可重复的代谢物,剔除了QC样本中变异系数大于30%的代谢物。如图2a和2e所示,QC样本之间的相关性较高,R2均大于99%,说明整个检测过程稳定性好,所采集的数据值得深入研究。
本研究对12只孕鼠的胎盘组织进行检测,共鉴定到正离子模式代谢物448个,负离子模式代谢物301个。PLS-DA(图2c和2g)结果显示,模型组正、负模式下的代谢物在样本中的分布明显偏离对照组,说明子痫前期孕鼠的胎盘代谢异常。火山图结果显示相比于对照组,模型组的正离子模式代谢物有15种上调,18种下调(图2d);负离子模式代谢物有13种上调,4种下调(图2h)。可见,差异代谢物更多的来源于正离子模式下检测到的代谢物,这与PCA的结果相一致(图2b),而负离子模式下代谢物在两组之间的分布差异相对不明显(图2f)。
三、差异代谢物鉴定与通路富集
如表2所示,本研究在子痫前期孕鼠的胎盘组织中共发现50种潜在的差异代谢物,上调的有28种,下调的有22种。将得到的差异代谢物在HMDB和LIPIDMaps数据库中进行对比,注释到分类的有40种,最明显的是脂质代谢异常。其中脂肪酰类代谢产物上调的有11种,主要包括酰基肉碱、白三烯B4和前列腺素A1;下调的有2种,分别是乙酰肉碱和支链脂肪酸酯。其次差异的甘油磷脂类代谢产物有5种且均上调,包括溶血磷脂酸、溶血磷脂酰丝氨酸和脂多糖。另外,杂环类有机化合物,核苷、核苷酸及类似物,以及氨基酸的衍生物均以下调为主,如水苏碱、烟酰胺、尿嘧啶和羟脯氨酸等。总体来说,在上调的差异代谢物中,模型组相比于对照组差异倍数最显著的是溶血磷脂酸丝氨酸和白三烯B4,其次是酰基肉碱;在下调的差异代谢物中,差异倍数较显著是水苏碱、丙酮酸和葫芦巴碱。
KEGG数据库对50种差异代谢物富集的通路涉及多种氨基酸的合成与代谢,泛酸和辅酶A的生物合成,烟酸和烟酰胺代谢以及脂质代谢等,其中苯丙氨酸、酪氨酸和色氨酸合成通路异常(P<0.05)。
表2 子痫前期孕鼠胎盘组织的差异代谢物及KEGG数据库富集的代谢通路
Table 2 Differential metabolites of placenta in the mice model of preeclampsia and pathways of KEGG

DifferentialmetabolitesPFCaVIPb ClassificationUp-regulated LPA18:20.02191.852.05Glycerophosphates LPS22:60.04611.881.86Glycerophosphates LPS20:50.02472.002.07Glycerophosphates LPS20:30.00972.072.37Glycerophosphates Lysops22:60.01166.682.04Glycerophosphates 20-Carboxy-LeukotrieneB40.01781.982.05FattyAcyls 8-Aminooctanoicacid0.00861.441.99FattyAcyls 10-Nitrolinoleate0.00111.702.28FattyAcyls ProstaglandinA1ethylester0.03901.871.88FattyAcyls 12-oxoLeukotrieneB40.00426.982.34FattyAcyls ACar17:00.02501.751.78FattyAcyls ACar14:30.03871.771.67FattyAcyls ACar22:60.03661.941.72FattyAcyls ACar18:30.04552.451.67FattyAcyls ACar16:30.04472.461.69FattyAcyls ACar18:50.04612.991.66FattyAcyls Nor-9-carboxy-δ9-THC0.03302.781.71Organoheterocycliccompounds Thymine0.02801.311.73Organoheterocycliccompounds Adenosine5′-diphosphoglucose0.04932.261.82Nucleosides,nucleotides,andanalogues Tetrahydrocorticosterone0.02702.821.80Steroidsandsteroidderivatives D-Threose0.00691.622.33Organicoxygencompounds α-Benzylsuccinicacid0.00831.642.24Phenylpropanoidsandpolyketides 12-epiLeukotrieneB40.04841.891.80— TaurochenodeoxycholicAcid0.02181.952.02— 4′-methylAcetylfentanyl-d50.03752.981.76— Methyl{[(2-oxo-2H-pyran-6-yl)carbonyl]amino}methanethioate0.01512.382.15— FQH0.03121.481.73— N-[(4-hydroxy-3-methoxyphenyl)methyl]-8-methylnonanamide0.00101.732.30—Down-regulated Aminoimidazolecarboxamideribonucleotide0.02390.342.13Nucleosides,nucleotides,andanalogues 2′-O-Methyluridine0.02560.581.92Nucleosides,nucleotides,andanalogues Acetyl-L-carnitine0.05000.681.67FattyAcyls FAHFA(22:5/18:2)0.04040.691.84FattyAcyls Methylimidazoleaceticacid0.02110.561.93Organoheterocycliccompounds Uracil0.02440.711.86Organoheterocycliccompounds Citrinin0.00720.812.02Organoheterocycliccompounds
表2(续)

DifferentialmetabolitesPFCaVIPb Classification Nicotinamide0.04660.861.61Organoheterocycliccompounds DL-Stachydrine0.00240.352.28Organoheterocycliccompounds Naringenin0.01690.811.92Phenylpropanoidsandpolyketides Sinapinicacid0.01830.851.86Phenylpropanoidsandpolyketides Quinicacid0.02960.591.96Organicoxygencompounds Trigonelline0.00830.441.96Alkaloidsandderivatives Epitestosterone0.02690.601.82Steroidsandsteroidderivatives Hydroxyproline0.03900.681.66Aminoacids,peptidesandanalogues O-Desmethylnaproxen0.03020.871.82Naphthalenes 2-deoxyglucose-6-phosphate0.03460.631.88— Phosphopyruvicacid0.03310.471.83— N-P-CoumaroylSpermidine0.02830.651.75— 8-(1,2-dihydroxy-3-methylbut-3-en-1-yl)-7-methoxy-2H-chromen-2-one0.00240.812.20— 1-(2-furyl)pentane-1,4-dione0.00850.811.97— 1-[4-mercapto-2-(2-methoxyphenyl)-6-methylpyrimidin-5-yl]et han-1-one0.00520.832.03—PathwayofKEGG Phenylalanine,tyrosineandtryptophanbiosynthesis0.0400 Pyrimidinemetabolism0.0709 PantothenateandCoAbiosynthesis0.1319 Nicotinateandnicotinamidemetabolism0.1921 β-Alaninemetabolism0.2486 Histidinemetabolism0.3018 Arginineandprolinemetabolism0.3516 Steroidhormonebiosynthesis0.4834
aFold change; bVariable important in projection
讨 论
本研究采用脂多糖暴露构建小鼠子痫前期疾病模型,而同样方式暴露脂多糖未引起非孕小鼠出现血压升高和蛋白尿的症状,说明脂多糖所诱导的子痫前期样表型具有妊娠期特异性;同时模型组胎盘结构异常,绒毛和滋养层细胞数量明显减少。以上是本研究选择胎盘组织作为研究对象的重要原因。进一步发现子痫前期孕鼠的胎盘组织代谢谱显著异常,差异代谢产物主要源于甘油磷脂、肉碱及酰基肉碱、白三烯和氨基酸;代谢通路主要涉及脂质代谢、氨基酸合成和代谢,以及能量合成。
人群研究受到样本取材时间受限以及混杂因素不一致的影响,动物研究可以更好地控制混杂因素,研究单一变量与结局之间的因果关联。所以,本研究首先选择动物模型来研究代谢物在子痫前期中的作用,以期为后续的人群靶向研究提供参考。截止目前,共发现5篇文献是应用代谢组学研究生物样本中代谢物在子痫前期动物模型中的作用[9-13](表3),模型的构建方式包括敲除儿茶酚胺氧位甲基转移酶基因(Comt-/-)[9]、静脉暴露可溶性FMS 样酪氨酸激酶-1(sFlt-1)重组腺病毒[10,12]以及行子宫动脉缩窄术(RUPP)[11,13]。脂多糖暴露也是诱导小鼠子痫前期的常见方式,然而目前尚无研究分析该造模方式下的代谢组学特征。本研究在小鼠孕中晚期采用低剂量多次暴露脂多糖来诱导子痫前期样表型,相比以往研究的造模方式可以更好地反映子痫前期慢性低炎症的发病过程,为深入探讨代谢谱的动态变化以及在疾病发病机制中的作用提供研究基础。另外,本研究的疾病模型存在一定的局限性,子痫前期是一种多病因、多机制的疾病,单一的造模方式难以准确地模拟其发病过程,日后研究需要更多地关注多种诱导剂结合的混合造模方式,以弥补该不足。以往研究得到的差异代谢物主要源于脂质和氨基酸代谢异常,其中仅一篇文献研究了子痫前期小鼠血清代谢谱的变化,发现甘油磷脂和鞘磷脂上调,酰基肉碱类代谢物下调[9],然而在血浆样本中发现肉碱和酰基肉碱上调[10,12],这与以往胎盘样本中的发现[12-13]以及本研究结果相一致。另外,差异的氨基酸及衍生物在血清(犬尿氨酸)[9]、血浆(酪氨酰苯丙氨酸)[11] 和胎盘(缬氨酸)[13] 样本中的含量均降低,在本研究的疾病模型中同样发现胎盘组织的氨基酸衍生物(羟脯氨酸)含量降低。
表3 基于代谢组学的代谢物在子痫前期大、小鼠模型中作用的研究现状
Table 3 Research on the role of metabolites in preeclampsia rat or mice based on metabolomics
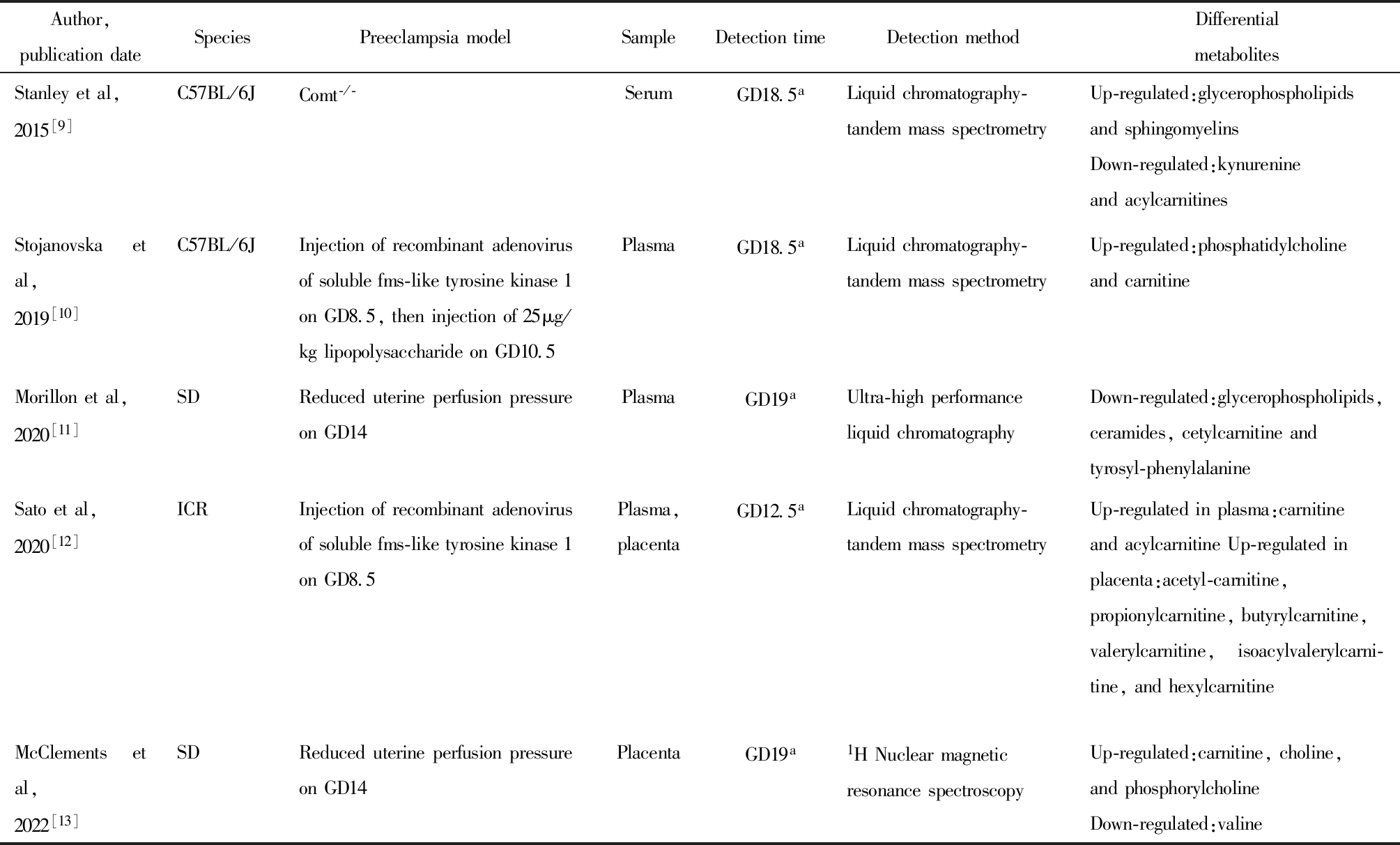
Author,publicationdateSpeciesPreeclampsiamodelSampleDetectiontimeDetectionmethodDifferentialmetabolitesStanleyetal,2015[9]C57BL/6JComt-/-SerumGD18.5aLiquidchromatography-tandemmassspectrometryUp-regulated:glycerophospholipidsandsphingomyelinsDown-regulated:kynurenineandacylcarnitinesStojanovskaetal,2019[10]C57BL/6JInjectionofrecombinantadenovirusofsolublefms-liketyrosinekinase1onGD8.5,theninjectionof25μg/kglipopolysaccharideonGD10.5PlasmaGD18.5aLiquidchromatography-tandemmassspectrometryUp-regulated:phosphatidylcholineandcarnitineMorillonetal,2020[11]SDReduceduterineperfusionpressureonGD14PlasmaGD19aUltra-highperformanceliquidchromatographyDown-regulated:glycerophospholipids,ceramides,cetylcarnitineandtyrosyl-phenylalanineSatoetal,2020[12]ICRInjectionofrecombinantadenovirusofsolublefms-liketyrosinekinase1onGD8.5Plasma,placentaGD12.5aLiquidchromatography-tandemmassspectrometryUp-regulatedinplasma:carnitineandacylcarnitineUp-regulatedinplacenta:acetyl-carnitine,propionylcarnitine,butyrylcarnitine,valerylcarnitine,isoacylvalerylcarni-tine,andhexylcarnitineMcClementsetal,2022[13]SDReduceduterineperfusionpressureonGD14PlacentaGD19a1HNuclearmagneticresonancespectroscopyUp-regulated:carnitine,choline,andphosphorylcholineDown-regulated:valine
a Gestational day
子痫前期的发病过程涉及血管内皮受损,凝血系统紊乱以及炎症反应等多种机制[15]。溶血磷脂酸、溶血磷脂酰丝氨酸和脂多糖不仅是细胞膜磷脂结构的组成成分,也可与G蛋白偶联受体结合,发挥细胞间信使调控信号通路的功能[16]。本研究与以往研究[9-10,13]均发现以上代谢产物显著增加,提示胎盘组织细胞明显受损[17],血管内皮受损后暴露出磷脂催化表面,促进凝血因子活化,从而导致凝血系统紊乱[18]。所以,甘油磷脂代谢异常可能与子痫前期的高凝状态息息相关。另外,花生四烯酸作为一种重要的不饱和脂肪酸,可通过环氧化酶和脂质氧化酶促进炎症因子白三烯和前列腺素的产生,进而参与炎症、过敏反应和心血管疾病等病理过程[19-21]。本研究发现子痫前期胎盘组织中的白三烯B4含量显著上调,前列腺素A1的含量也明显上调,相关研究结果提示胎盘炎症反应增加是子痫前期发病的重要机制。
子痫前期动物模型的不同生物样本中均发现氨基酸代谢失调[11,13],本研究构建的疾病模型中也发现了多种氨基酸合成和代谢异常,包括苯丙氨酸、酪氨酸和色氨酸生物合成,组氨酸、精氨酸和脯氨酸代谢。苯丙氨酸最主要代谢途径是经羟化酶催化生成酪氨酸,进一步生成多巴胺;色氨酸合成异常会引起5-羟色胺代谢紊乱[22]。有研究证实多巴胺和5-羟色胺可引起血管内皮细胞的一氧化氮和内皮素表达异常,血管收缩,血压升高[23]。提示子痫前期的高血压症状可能与胎盘苯丙氨酸、酪氨酸和色氨酸生物合成和代谢通路紊乱有关。
本研究发现子痫前期孕鼠的胎盘组织中丙酮酸和烟酰胺含量明显降低,同时KEGG数据库对如上差异代谢物富集的通路涉及泛酸和辅酶A生物合成以及烟酸和烟酰胺代谢。烟酰胺[24]、泛酸和辅酶A[25]是体内多种酶反应通路的重要辅助因子,可参与糖、脂肪酸和丙酮酸分解,提供机体所需的大部分能量。胎儿在宫内的正常生长发育需要足够的能量供应,本研究推测子痫前期小鼠出现的宫内发育不良、吸收胎以及死胎等不良妊娠结局可能是由于胎盘组织中异常的丙酮酸、烟酰胺、泛酸和辅酶A阻碍了能量的合成。
本研究还发现子痫前期胎盘组织中的肉碱和酰基肉碱水平增加,但乙酰肉碱水平降低。相比于以往研究,本研究发现不同酰基肉碱的含量变化不一[11-12],肉碱和酰基化肉碱是参与脂肪酸运输和氧化供能的主要物质[26],明确其变化规律可以更好地理解子痫前期疾病机制。人群研究已证实了子痫前期孕妇的血浆样本中肉碱水平与血脂代谢息息相关,二者的含量随着疾病进展而发生变化[27]。如上结果提示胎盘组织中肉碱和酰基肉碱代谢失调可能与子痫前期血脂代谢密切相关,未来需要在疾病不同发展阶段进一步探索肉碱代谢失调在子痫前期发生发展中的效应机制。
本研究基于非靶向代谢组学对子痫前期胎盘的内源性小分子代谢物进行检测,共筛选出50种潜在的差异代谢物,与以往相关研究对比分析发现甘油磷脂、肉碱及酰基肉碱、白三烯和氨基酸代谢异常。异常代谢物主要涉及的通路是脂质代谢、氨基酸和能量合成。提示子痫前期发病机制可能涉及了胎盘炎症反应、能量合成、脂肪酸和氨基酸代谢紊乱。未来需要更深入的靶向研究对潜在差异代谢物进行验证,以明确胎盘代谢在子痫前期疾病中的作用机制。
(图1~2见封底)
1 中华医学会妇产科学分会妊娠期高血压疾病学组,妊娠期高血压疾病诊治指南(2020).中华妇产科杂志,2020,55:227-238.
2 Chappell LC,Cluver CA,Kingdom J,et al.Pre-eclampsia.Lancet,2021,398:341-354.
3 Duley L.The global impact of pre-eclampsia and eclampsia.Semin Perinatol,2009,33:130-137.
4 吕莉娟,段红丽,李慧,等.子痫前期对子代远期不良影响.中华围产医学杂志,2019,5:357-360.
5 Yang Y,Le Ray I,Zhu J,et al.Preeclampsia Prevalence,Risk Factors,and Pregnancy Outcomes in Sweden and China.JAMA Netw Open,2021,4:e218401.
6 Xiao J,Shen F,Xue Q,et al.Is ethnicity a risk factor for developing preeclampsia? An analysis of the prevalence of preeclampsia in China.J Hum Hypertens,2014,28:694-698.
7 Hoang G,Udupa S,Le A.Application of metabolomics technologies toward cancer prognosis and therapy.Int Rev Cell Mol Biol,2019,347:191-223.
8 Nalbantoglu S,Karadag A.Metabolomics bridging proteomics along metabolites/oncometabolites and protein modifications:Paving the way toward integrative multiomics.J Pharm Biomed Anal,2021,199:114031.
9 Stanley JL,Karolina S,Irene JA,et al.Sildenafil Therapy Normalizes the Aberrant Metabolomic Profile in theComt(-/-) Mouse Model of Preeclampsia/Fetal Growth Restriction Sci Rep,2015,5:18241.
10 Stojanovska V,Dijkstra DJ,Vogtmann R,et al.A double-hit pre-eclampsia model results in sex-specific growth restriction patterns.Dis Model Mech,2019,12:dmm035980.
11 Morillon AC,Williamson RD,Baker PN,et al.Effect of L-Ergothioneine on the metabolic plasma profile of the RUPP rat model of pre-eclampsia.PLoS One,2020,15:e0230977.
12 Sato E,Tsunokuni Y,Kaneko M,et al.Metabolomics of a mouse model of preeclampsia induced by overexpressing soluble fms-like tyrosine kinase 1.Biochem Biophys Res Commun,2020,527:1064-1071.
13 McClements L,Richards C,Patel N,et al.Impact of reduced uterine perfusion pressuremodel of preeclampsia on metabolism of placenta,maternal and fetal hearts.Sci Rep,2022,12:1111.
14 Li G,Wei W,Suo L,et al.Low-Dose Aspirin Prevents Kidney Damage in LPS-Induced Preeclampsia by Inhibiting the WNT5A and NF-κB Signaling Pathways.Front Endocrinol,2021,11:639592.
15 Roberts JM,Hubel CA.Thetwo stage model of preeclampsia:variations on the theme.Placenta,2009,30:32-37.
16 Hossain MS,Mineno K,Katafuchi,T.Neuronal Orphan G-Protein Coupled Receptor Proteins Mediate Plasmalogens-Induced Activation of ERK and Akt Signaling.PLoS One,2016,11:e0150846.
17 Farooqui AA,Horrocks LA,Farooqui T.Interactions between neural membrane glycerophospholipid and sphingolipid mediators:a recipe for neural cell survival or suicide.J Neurosci Res,2007,85:1834-1850.
18 Sang Y,Roest M,de Laat B,et al.Interplay between platelets and coagulation.Blood Rev,2021,46:100733.
19 Konyshev VA,Marokko IN,Shaternikov VA.Arachidonic acid metabolites,leukotrienes--mediators of hypersensitivity and inflammation.Nauchnye Doki Vyss Shkoly Biol Nauki,1985,12:14-24.
20 Szczuko M,Kikut J,Komorniak N,et al.The Role of Arachidonic and Linoleic Acid Derivatives in Pathological Pregnancies and the Human Reproduction Process.Int J Mol Sci,2020,21:9628.
21 Francois H,Coffman TM.Prostanoids and blood pressure:which way is up?.J Clin Invest,2004,114:757-759.
22 Yao K,Fang J,Yin YL,et al.Tryptophan metabolism in animals:important roles in nutrition and health.Front Biosci (Schol Ed),2011,3:286-297.
23 张静,王宇光.多巴胺在子痫前期及妊娠期高血压中的作用及其研究的进展.心血管康复医学杂志,2022,31:111-114.
24 Nikas IP,Paschou SA,Ryu HS.The Role of Nicotinamide in Cancer Chemoprevention and Therapy.Biomolecules,2020,10:477-497.
25 Naquet P,Kerr EW,Vickers SD,et al.Regulation of coenzyme A levels by degradation:the ′Ins and Outs′.Prog Lipid Res,2020,78:101028.
26 Pekala J,Patkowska-Sokola B,Bodkowski R,et al.L-carnitine--metabolic functions and meaning in humans life.Curr Drug Metab,2011,12:667-678.
27 董升栋,杨祖菁.子痫前期与血肉碱关系的研究.山西医药杂志,2009,38:494-496.