体外受精(In vitro Fertilization,IVF)和胚胎移植(Embryo Transfer,ET)是临床上治疗不孕症的重要技术手段。在人类辅助生殖技术(ART)实践中,胚胎培养室是人类配子操作和胚胎培育的核心功能区,受多种复杂因素影响,其中胚胎培养环境的气体质量、培养体系的可靠性及稳定性、人工操作质控水平等至关重要,事关配子机能稳定性及相互作用、胚胎发育质量和IVF-ET周期的治疗结局 [1-2]。既往研究表明,鼠胚实验(Mouse Embryo Assay,MEA)[3]是综合性评价胚胎培养室合格与否的有效方法。本文通过MEA对本院生殖医学中心新建胚胎培养室的培养体系和操作稳定性进行了临床前评估,现报告如下。
材料与方法
一、实验材料
1.实验动物:雌性昆明鼠(4~6周龄,体重25~35 g)、雄性昆明鼠(8周龄以上,体重40~50 g)购自新疆维吾尔自治区疾病预防控制中心,饲养温度21~25 ℃,水、饲料供应充足。每批雌鼠均在计划实验前20 d开始饲养。
2.试剂耗材:兽用PMSG和HCG(1 000 IU粉剂/支)均购自宁波三生药业,HCG用0.9%生理盐水5mL稀释为200 IU/mL的浓储液储存,PMSG用5 mL PMSG稀释液稀释成200 IU/mL的浓储液,-20℃保存备用。G-MOPS PLUS、G-IVF PLUS、G-1 PLUS、G-2 PLUS和石蜡油均为Vitrolife公司产品。3001皿、四孔皿、1 mL移液管、10 mL移液管均购自FALCON公司;高纯度氮气(99.999%)、高纯二氧化碳气(99.999%)购自大连大特气体有限公司。
3.主要仪器设备:Stemi 508 体视显微镜购自德国卡尔蔡司公司;G-185三气培养箱、C-60二氧化碳培养箱分别购自丹麦K-system公司和德国Labtech公司;ECLIPSE Ti倒置显微镜为日本尼康公司产品;Sterile180工作站购自丹麦IVFtech公司。
二、实验方法
1.实验分组:按照受精方式不同,采用配对随机化设计,将促排雌鼠随机分为体内受精组和体外受精组,共7批次两组各20个周期。以其中一个批次的配对随机化为例,首先将20只雌鼠编为1~20号后称重,同体重或体重非常接近的两只雌鼠配成一个对子,共配成10对并依次编为A~J,然后从“随机数字表”的任何一页、任何一处开始,以一定方向抄下10个数字并依次排在配对号下,分组时,凡随机数字为单数者,该对子中的第一只雌鼠分入甲组,而同对子中的另一只雌鼠归入乙组,若随机数字为双数,就把该对子中的第一只雌鼠分入乙组,而同对子中的另一只雌鼠则归入甲组。
体内受精组与雄性小白鼠交配,D1获取体内受精胚胎进行体外培养;体外受精组直接获取卵母细胞,通过体外受精后进行体外培养。
2.体外受精:(1)促排卵和鼠卵采集。体外受精组雌性小鼠于18:00进行腹腔注射PMSG 10 IU,48 h后腹腔注射HCG 10 IU。16~18 h后颈椎脱臼法处死雌鼠,在无菌条件下取出膨大的输卵管,放入盛有G-MOPS PLUS的培养皿中,用一次性1 mL注射器刺破输卵管膨大部,将卵母细胞团收集到G-IVF PLUS受精皿中,放入37 ℃,5% CO2,90%湿度的培养箱。(2)鼠精采集和获能。颈椎脱臼法处死雄鼠并开腹,在无菌条件下分离附睾尾放入G-IVF PLUS受精液中,用一次性1 mL注射器小心刺破输精管,轻轻挤压出精子,收集精子悬浮液,放入37℃、6% CO2、饱和湿度的培养箱中获能30~60 min。(3)体外受精及胚胎观察。采用四孔皿集中受精法。记录获卵数,将所获鼠卵分配至四孔皿中,每孔10~20个卵不等;吸取获能精子悬液到含有卵子的培养液中,放入37 ℃、6% CO2、饱和湿度的培养箱中孵育。受精后20 h观察2-细胞,30~40 h 观察4-细胞,60~70 h观察8-细胞及桑葚胚,90 h后观察囊胚。
3.体内受精:同日下午18:00,将体内受精组注射HCG后的雌鼠与雄鼠按1:1比例合笼,次日早晨观察雌鼠的阴道栓形成情况。将有阴道栓的雌鼠处死,获取卵子。获取2-细胞方法同体外受精组。
4.统计学分析:计录卵裂数和囊胚形成数,其中如受精卵分裂成为2-细胞胚胎即认为卵裂,分别计算2-细胞卵裂率(即2-细胞数/获卵数)和囊胚形成率(即囊胚形成数/2-细胞数)。应用SPSS 19.0对实验数据行统计学分析,χ2检验用于率的比较;P<0.05为差异具有统计学意义。
结 果
一、鼠胚发育的形态学观察(×100)
促排后获得小鼠卵母细胞团见图1A,图1B至图1F依次为受精卵(图1B)、2-细胞鼠胚(图1C)、4-细胞和8-细胞鼠胚(图1D)、桑葚胚(图1E)和囊胚(图1F)。
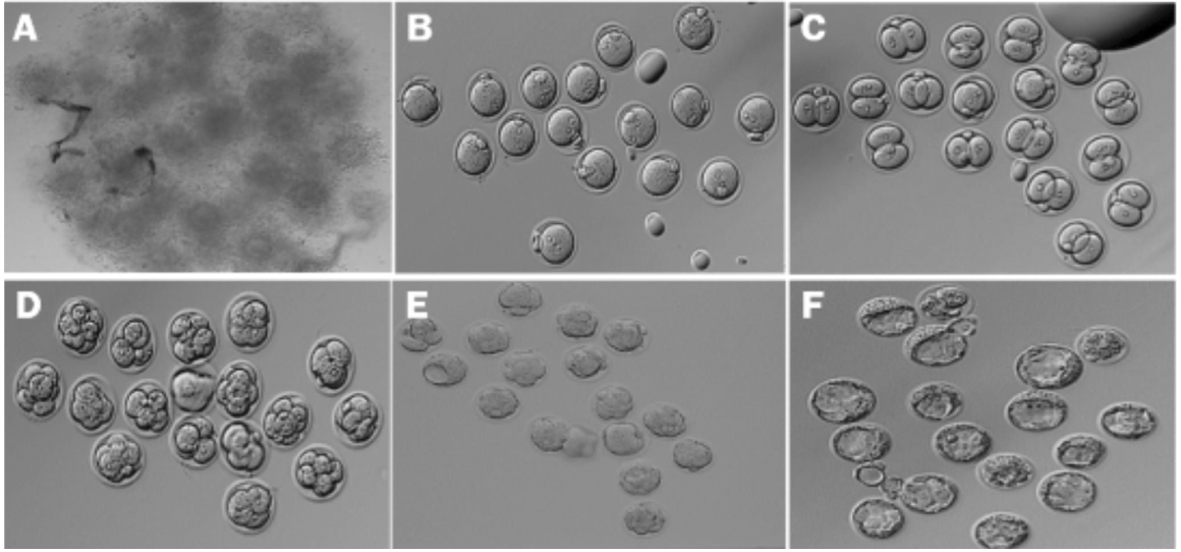
图1 小鼠卵母细胞体外受精后的胚胎发育(×100)
Fig 1 Embryo development ofin vitro fertilized mouse oocytes(×100)
二、卵裂率和囊胚形成率
体内受精组和体外受精组分别开展了7批次各20 个周期的胚胎培养。IVF 周期共获卵805 枚,结果见表1,其中 2-细胞胚胎数720 枚,卵裂率为89.4%,形成囊胚656 个,囊胚形成率为90.3%(表1)。
表1 昆明小鼠体外受精(IVF)实验结果
Table 1 Data analysis of in vitro fertilization experiments in Kunming breed mice
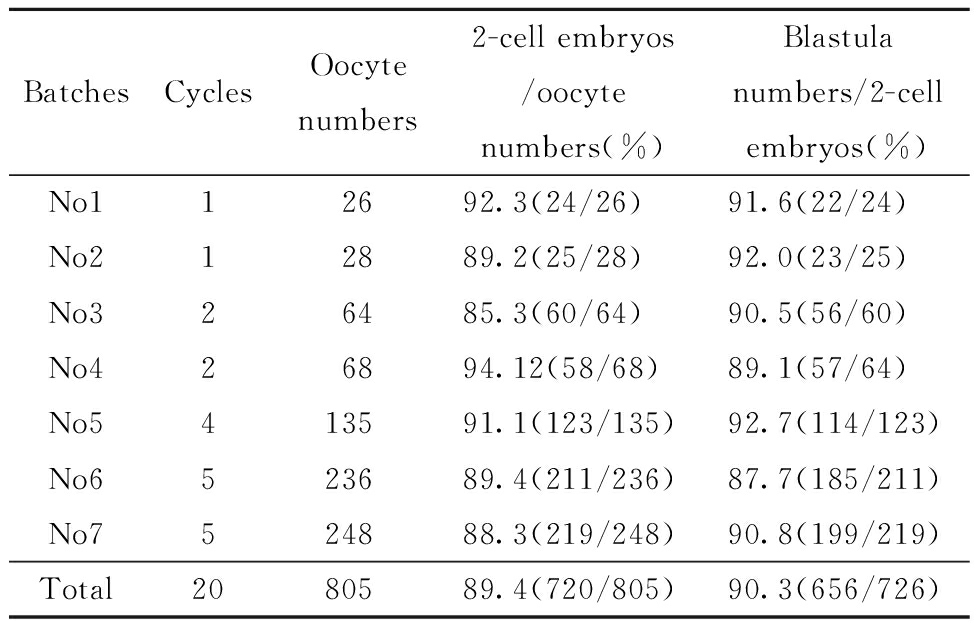
BatchesCyclesOocytenumbers2-cell embryos/oocyte numbers(%)Blastula numbers/2-cell embryos(%)No112692.3(24/26)91.6(22/24)No212889.2(25/28)92.0(23/25)No326485.3(60/64)90.5(56/60)No426894.12(58/68)89.1(57/64)No5413591.1(123/135)92.7(114/123)No6523689.4(211/236)87.7(185/211)No7524888.3(219/248)90.8(199/219)Total2080589.4(720/805)90.3(656/726)
体内受精组共获卵752 枚,其中 2-细胞胚胎数708个,卵裂率为94.1%,形成囊胚652 个,囊胚形成率为92.1%(表2)。
表2 昆明小鼠体内受精体外培养实验结果
Tab 2 Data analysis of in vivo fertilization experiments of Kunming breed mice
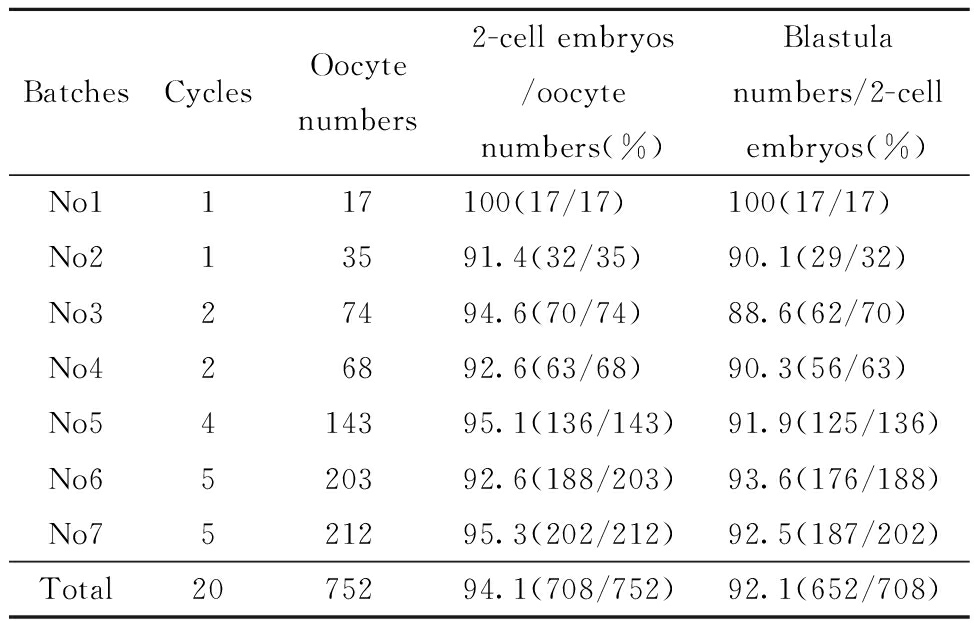
BatchesCyclesOocytenumbers2-cell embryos/oocyte numbers(%)Blastula numbers/2-cell embryos(%)No1117100(17/17)100(17/17)No213591.4(32/35)90.1(29/32)No327494.6(70/74)88.6(62/70)No426892.6(63/68)90.3(56/63)No5414395.1(136/143)91.9(125/136)No6520392.6(188/203)93.6(176/188)No7521295.3(202/212)92.5(187/202)Total2075294.1(708/752)92.1(652/708)
体内受精和IVF 周期的比较见表3,体内受精组卵裂率显著高于体外受精组(P<0.05),而两组间囊胚形成率无显著差异。
表3 体外受精组和体内受精组的结果比较
Tab 3 Comparison betweenin vitro and in vivo fertilization groups
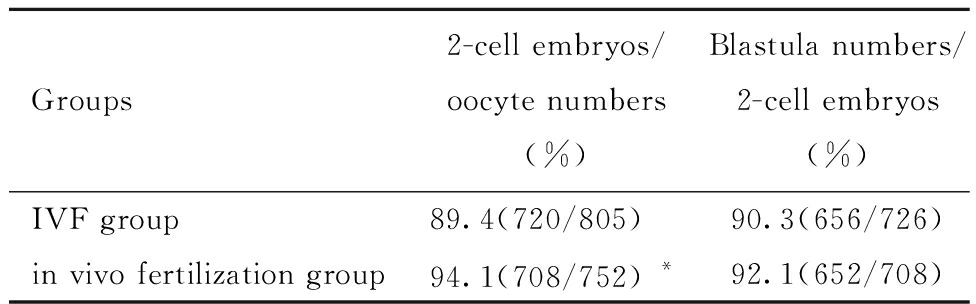
Groups2-cell embryos/oocyte numbers(%)Blastula numbers/2-cell embryos(%)IVF group89.4(720/805)90.3(656/726)in vivo fertilization group94.1(708/752) *92.1(652/708)
Note:Compared with IVF group, *P<0.01
讨 论
在新装修的胚胎培养室内部环境下开展鼠胚实验(MEA),建立合理化配子及胚胎操作流程,考察新建胚胎培养室环境可靠稳定性和人员配子及胚胎操作熟练程度,为新建胚胎培养室的临床前应用提供保证[4-8]。鼠胚实验关键环节主要涉及雌鼠控制性促排卵、鼠卵体外受精和受精卵体外培养,期间所涉及的胚胎培养室环境质量、设备、材料、试剂和方法等步骤与开展人类辅助生殖技术流程和要求具有通用性,因此,鼠胚实验中受精鼠卵的卵裂率、囊胚形成率等是综合判断新建胚胎培养室环境、材料质量和人员基本技术水平的主要常用指标。
本研究采用体内受精和体外受精方法,共开展了7个批次、两组各20个周期的鼠胚实验,体内受精和IVF组分别获得受精卵752和805个,体内、体外两组的总体卵裂率分别为94.1%和89.4%,体内受精组的卵裂率明显高于体外受精组,可能与每批次小鼠个体差异、对环境适应性不同以及对促排卵药物的反应性差异有关,体外受精组略低于体内受精组,也可能受胚胎体外操作期间环境应激影响。数据表明,体外受精组的卵裂率介于85.3%~94.1%之间、囊胚形成率介于87.7%~92.7%之间,体内受精组的卵裂率和囊胚形成率分别介于91.4%~100%之间和88.6%~100%之间,总体上均高于85%的要求。体内、体外两组实验的整体囊胚形成率分别为92.1%和90.3%,组间未见统计学差异。上述结果说明,本新建实验室的体外受精胚胎培养体系及人员操作技术水平达标常规开展ART的基本需求。
1 Morbeck DE.Importance of supply integrity for in vitro fertilization and embryo culture.Semin Reprod Med,2012,30:182-190.
2 廉颖,刘平,乔杰.辅助生殖技术实验室的质量控制体系.生殖与避孕,2018,38:636-639.
3 黄国宁,刘东云,韩伟.辅助生殖技术实验室的建设及其质量控制.中国实用妇科与产科杂志,2010,26:755-758.
4 徐薇,付景丽,石云,等.鼠胚实验在新建IVF实验室中的质控作用.国际检验医学杂志,2018,39:1701-1704.
5 柳岚,吴兵平,李志敏,等.新建辅助生殖实验室的鼠胚培养质控及鼠卵显微注射分析.生殖医学杂志,2020,29:98-102.
6 高亚可,杜姗姗.新建辅助生殖实验室的鼠胚实验报告.广西医学,2016,38:304-307.
7 Stamatkin CW,Roussev RG,Stout M,et al.Preimplantation factor(PIF) correlates with early mammalian embryo development-bovine and murine models.Reprod Biol Endocrinol,2011,9:63.
8 谭玉梅,宋革,祝晓丽,等.小鼠胚胎培养在新建辅助生殖实验室质量控制中的作用.中国计划生育和妇产科,2015,7:27-29,36.