女性盆腔器官脱垂(pelvic organ prolapse,POP)是妇女常见疾病,严重影响患者的生活质量。在50~79岁年龄段妇女中,约 40%有不同程度的盆底器官脱垂症状[1]。宫旁韧带组织是支持盆腔结构的重要部分。子宫位于骨盆腔中央位置,由四对韧带固定,分别是阔韧带、圆韧带、主韧带、宫骶韧带,这四对韧带各发挥不同的作用。阔韧带由子宫侧缘向外侧伸展到达骨盆侧壁,使子宫保持在骨盆中央位置,限制子宫向侧方移位。圆韧带和宫骶韧带使子宫维持在前倾前屈位置。圆韧带直接维持子宫前倾位。宫骶韧带的作用是向后上方牵引子宫颈,有间接维持子宫前倾的作用。主韧带主要固定宫颈,起自宫颈上部的两侧,向后方附于盆壁上,防止子宫向侧方移位。在女性一生当中, 宫旁韧带组织要受到重力、妊娠、分娩、咳嗽、排便等各种力的作用, 站立、日常活动、体力劳动、举重练习时腹压增大, 当腹压过大时, 间断或持续增大的应力作用会损伤宫旁韧带组织。而宫旁韧带的损伤是POP发生的重要环节[1]。本研究拟检测机械应力对人子宫旁韧带成纤维细胞增殖及胶原代谢的影响以探讨其在 POP发生发展中的作用及机制。
材料与方法
一、样本来源
选取于2020年2月—2020年5月上海市第一妇婴保健院医院妇科因良性肿瘤行子宫全切手术的患者5例,患者年龄43~49岁,平均年龄为(45.6±2.5)岁,均无盆底功能障碍疾病,均未绝经。患者均知情同意,并签署知情同意书,本研究经医院伦理委员会审核同意。
二、方法
1.原代骶韧带成纤维细胞培养:将新鲜骶韧带组织切成碎片,I型胶原酶(SCR103,Merck KGaA, Darmstadt, Germany)和胰酶(T4174,Merck KGaA, Darmstadt, Germany)消化后于10%胎牛血清(S181-F500; Biowest, Paris, France)的DMEM 培养基(C11995500BT;Gibco, Waltham, MA, USA)在细胞培养箱中培养,当细胞融合度达到70%~80% 时进行传代,本研究使用第 3~5 代生长良好的成纤维细胞。
2.原代成纤维细胞鉴定:原代成纤维细胞在载玻片中培养至50% 融合度,随后洗涤、固定,用 0.4% Triton X-100 及3% 过氧化氢处理。小鼠抗人波形蛋白单克隆抗体(200 μg/mL)孵育细胞,4℃ 过夜;用 PBS 代替一抗作为阴性对照。二抗孵育。显微镜观察并拍照。
3.细胞应力培养:原代成纤维细胞以每孔5×104细胞/培养孔的密度接种在6孔柔性培养板上(Flexcell公司,McKeesport, PA,USA)。待细胞长至75%~80%融合时,更换无血清培养液同步化细胞12 h。使用Flexercell细胞拉力培养系统(Flexcell 公司,McKeesport, PA,USA)对细胞进行拉伸应力培养12 h或24 h。以培养皿底部硅胶膜拉伸应变率(%)表示细胞所受力值大小,细胞所受张力随着拉伸率的增大而增大,将细胞的力值定为0%(对照组)、6%、12% 及18% 表面伸长率,频率为6 循环/分钟,每一循环包括3秒伸展/3秒放松。每次实验,每组均设重复,计算时取均值;相同实验均重复4次(均为不同标本取材,即n--4)进行统计学分析。
4.细胞增殖检测:原代成纤维细胞以每孔5×104细胞/培养孔的密度接种在6孔柔性培养板上。待细胞长至75%~80%融合,无血清培养液同步化细胞12 h后加力培养12 h、24 h。在细胞培养满48 h后加入CCK-8试剂(美国MCE公司),孵育4 h后,酶标仪检测吸光度值,波长取460 nm。计算细胞增殖率。
5.实时荧光定量PCR(qPCR)检测MMP-2、TIMP-1、I型胶原蛋白(Collagen I)、Ⅲ型胶原蛋白(Collagen Ⅲ)及LOXL1 mRNA的表达:采用 Trizol 法 对 总 RNA进行 提 取,逆转录过程中严格逆转录试剂盒操作步骤。在荧光定量实时 PCR 仪上对所 得 cDNA 进行反应。按照说明使用 Power SYBR GreenPCR MasterMix 试剂盒,内参照为 β-actin。PCR反应参数:95℃预变性15 min, 95℃ 变性10 s,60℃退火和延伸20 s,7℃ 25 s,共35 个循环。7300 System SDS Software 分析数据,2-ΔΔCT法计算MMP-2、TIMP-1、Collagen I、CollagenⅢ及LOXL1 mRNA的相对表达量。引物序列见表1。
表1 基因的引物序列
Table 1 The primer sequence of the genes

Gene Primer SequenceMMP-2 forward5′-CGCTCAGATCCGTGGTGAG-3′ reverse5′-CTTGTCACGTGGGCGTCACA-3′TIMP forward5′-CCACCTTATATACCAGCGTTATC-3′ reverse5′-GGCAAAGTGATCGCTCTG-3′β-actin forward5′-GATGACGATATCGCTGCGCT-3′ reverse5′-ATAGCTCTTCTCCAGGGAGG-3′LOXL1 forward5′-CCTGGGAACTACA7rCCECAA-3′, reverse5′-CGGAGATCAGGATTGGACA-3′CollagenI forward5′-ACAGCcGClrrcACCTACAGC-3′ reverse5′-TCAATCACTGTC′FI"GCCCCA-3′CollagenⅢ forward5′-TCl-rGGlrcAGcTCTATGcGGA-3′ reverse5′-TGTCATCGCAGAGAACGGATC-3′
6.观察内容:(1)鉴定成纤维细胞;(2)观察不同(6%、12%及18%)拉伸应力下作用12 h 及24 h对成纤维细胞的增殖能力的影响及对MMP-2、TIMP-1、Collagen I、Collagen Ⅲ和LOXL1 mRNA的表达的影响。
7.统计学处理:应用 SPSS 21.0 软件,计量数据以均数±标准差表示,两组比较采用 t 检验,两组以上比较采用方差分析。P<0.05 为差异有统计学意义。
结 果
一、成纤维细胞的鉴定
倒置显微镜下观察宫骶韧带成纤维细胞。细胞多呈梭形,边界清楚,细胞体较大,细胞质透明(图1)。成纤维细胞的Vim免疫组化染色。核周的胞质呈棕黄色阳性染色。
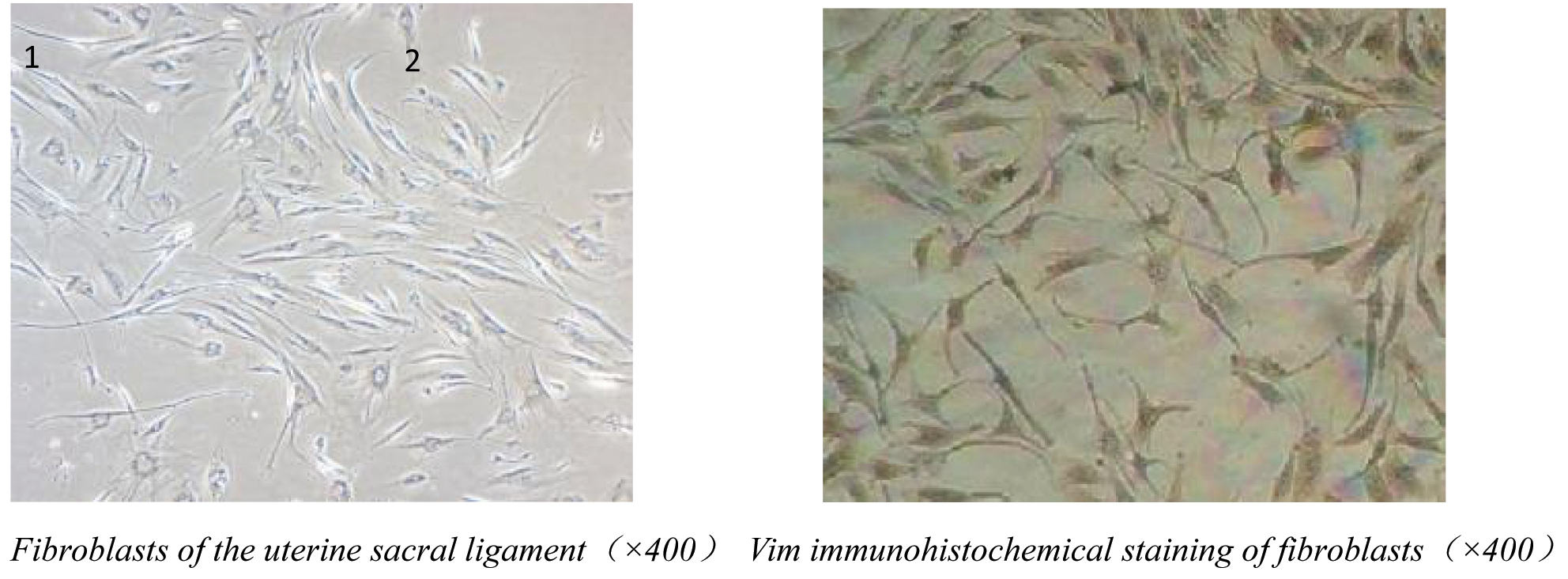
图1 倒置显微镜下宫骶韧带成纤维细胞和成纤维细胞的Vim免疫组化
Figure 1 Vim immunohistochemistry of uterine sacral ligament fibroblasts and fibroblasts under an inverted microscope
二、拉伸应力对成纤维细胞的增殖能力的影响
结果提示,6%的拉伸应力作用12 h对成纤维细胞的增殖能力有增强的趋势,但差异无显著性(P>0.05), 12%及18%的拉伸应力培养12 h对成纤维细胞的增殖能力有明显抑制作用(P<0.05),但两组间无明显差异(P>0.05)。6%、12%及18%的拉伸应力作用24 h均对细胞的增殖能力有明显抑制作用(P<0.05),且12%及18%应力较6%应力抑制作用更大(P<0.05),但12%与18%应力间无明显差异(P>0.05)。此外,随着作用时间延长(24 h vs 12 h),6%、12%及18% 的应力对细胞的增殖作用抑制更明显(P<0.01)。见图2。

Control group(0% stress);a vs Control group,P<0.05;b vs 6% group,P<0.001
图2 不同拉伸应力作用12 h及24 h对成纤维细胞的增殖能力的影响
Figure 2 Effects of different tensile stresses on fibroblast proliferation for 12 h and 24 h
三、拉伸应力对成纤维细胞的MMP-2、TIMP-1、Collagen I、Collagen Ⅲ及LOXL1 mRNA的表达的影响
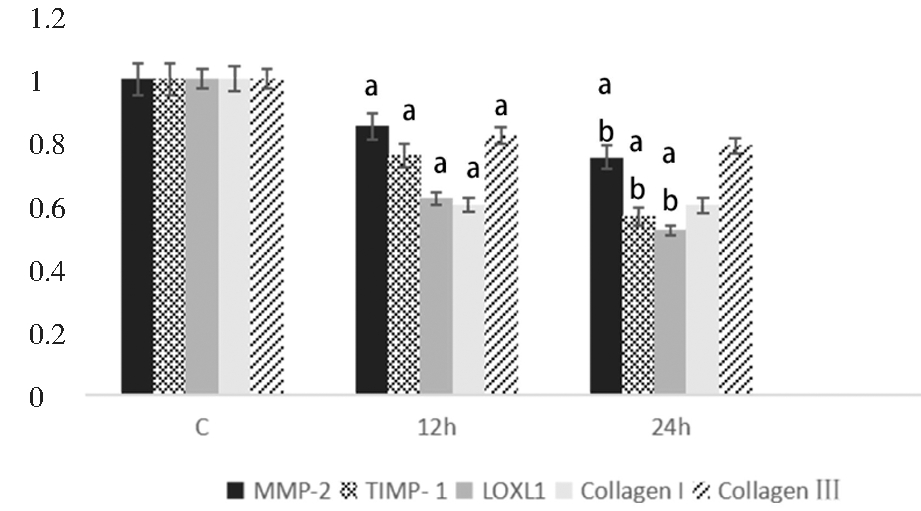
将成纤维细胞分别在6%、12%及18%的拉伸应力下培养12 h及24 h,发现6%的拉伸应力作用12 h及24 h,成纤维细胞MMP-2、TIMP-1、Collagen I、Collagen Ⅲ及LOXL1 mRNA表达较对照组有升高趋势,但差异不显著(P >0.05); 12%及18%的拉伸应力作用下,成纤维细胞MMP-2、TIMP-1、Collagen I、Collagen Ⅲ 及LOXL1 mRNA 的表达均较对照组明显降低(P<0.05);且随着应力增加(12% vs 18%)表达都有进一步下降的趋势,其中LOXL1 mRNA 的表达有进一步的显著性下降(P<0.05)。见图3、图4。
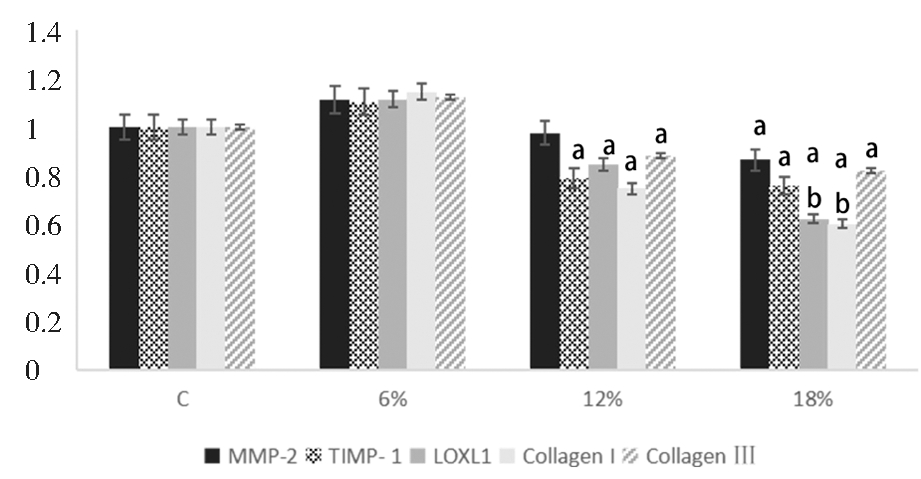
C:Control group(0% stress).a vs Control group,P<0.05 ;b vs 12% group,P<0.05
图3 不同强度拉伸应力作用12 h下成纤维细胞MMP-2、TIMP-1、LOXL1、Collagen I、Collagen Ⅲ的mRNA表达
Figure 3 The mRNA expressions of MMP-2, TIMP-1, LOXL1, Collagen I and Ⅲ in fibroblasts after different tensile stresses for 12 h
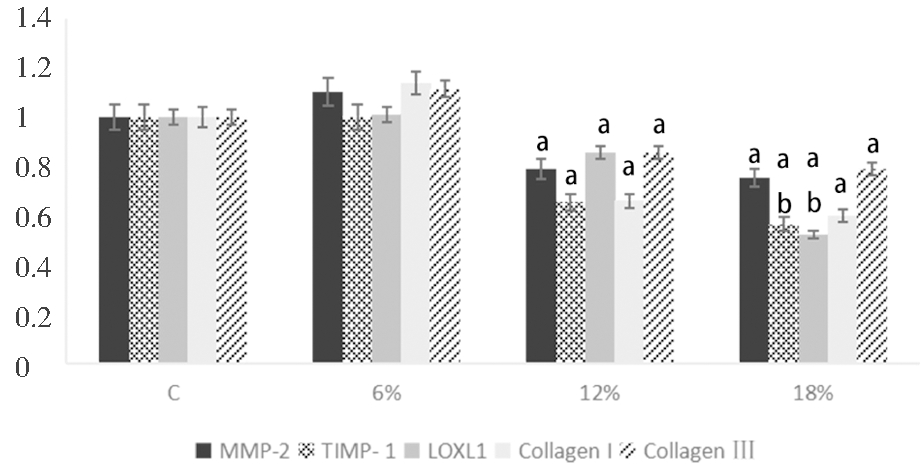
C:Control group(0% stress).a vs Control group,P<0.05 ;b vs 12% group,P<0.05
图4 不同强度拉伸应力作用24 h下成纤维细胞MMP-2、TIMP-1、LOXL1、Collagen I、Collagen Ⅲ 的mRNA表达
Figure 4 The mRNA expressions of MMP-2, TIMP-1, LOXL1, Collagen I and Ⅲ in fibroblasts after different tensile stresses for 24 h
进一步分析发现随着应力作用时间延长(24 h vs.12 h),MMP-2、TIMP-1、Collagen I mRNA的表达明显下降(P<0.05),而Collagen Ⅲ及LOXL1 mRNA 的表达差异无统计学意义。见图5、图6。
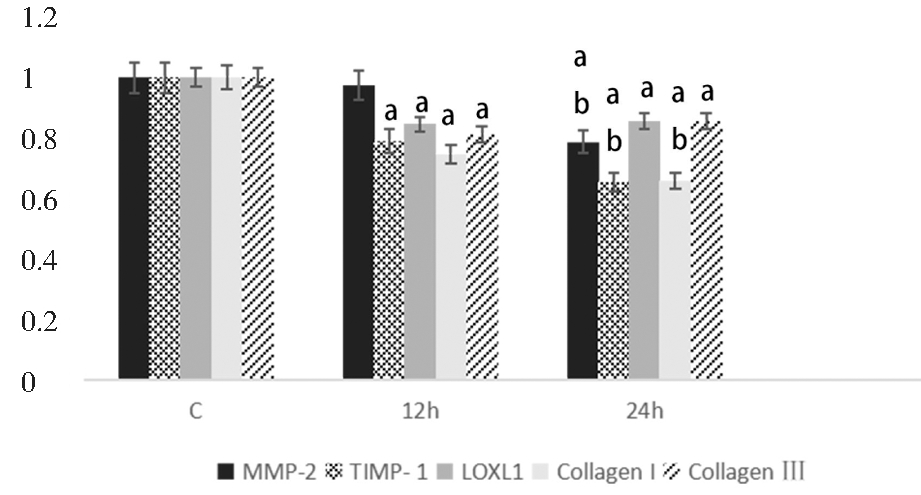
C:Control group(0% stress).a vs Control group,P<0.05 ;b vs 12h group,P<0.05
图5 12%拉伸应力不同作用时间下成纤维细胞MMP-2、TIMP-1、LOXL1、Collagen I、Collagen Ⅲ mRNA的表达
Figure 5 The mRNA expressions of MMP-2, TIMP-1, LOXL1, Collagen I and Ⅲ in fibroblasts after 12% tensile stress by different treatment time
C:Control group(0% stress).a vs Control group,P<0.05 ;b vs 12 h group,P<0.05
图6 18%拉伸应力不同作用时间下成纤维细胞MMP-2、TIMP-1、LOXL1、Collagen I、Collagen Ⅲ mRNA的表达
Figure 6 The mRNA expressions of MMP-2, TIMP-1, LOXL1, Collagen I and Ⅲ in fibroblasts after 18% tensile stress bydifferent treatment time
此外,各基因中,TIMP-1、Collagen I及LOXL1 mRNA 表达下降相对更大,相较对照组下降的最大幅度分别达到 43.6%、40.1%及47.9%;而Collagen Ⅲ及MMP-2下降最大幅度相对较小,分别为21.1%及24.8%。
讨 论
妊娠、分娩、长期咳嗽、长期便秘、长期负重等是导致POP发生的重要原因[1]。这些情况下,腹腔内会产生过大的压力作用于包括宫旁韧带在内的盆底的支持结构。本研究通过对宫旁韧带成纤维细胞的在应力下的培养模拟了女性盆底的宫旁韧带组织在受到来自腹腔的压力时,其成纤维细胞所处的应力环境,主要研究了此情况下成纤维细胞胶原蛋白代谢的变化。
胶原蛋白的代谢异常与POP的发生密切相关。在盆底支持组织中起主要作用的是子宫主韧带、子宫骶韧带、肛提肌以及阴道壁结构等。研究发现,POP患者的盆底组织的力学性能明显下降[2-3]。组织的力学特性归根结底是由蛋白质的力学特性决定的。盆底支持结构的主要成分是平滑肌和结缔组织,而结缔组织的主要蛋白质成分之一为胶原,占机体蛋白的25%左右。盆底筋膜主要由I型和Ⅲ型胶原构成,I型胶原与支持作用有关,硬度大、直径粗,占胶原蛋白总量的80%~90%%,Ⅲ型胶原与组织的弹性有关,弹性大,直径较细[1-2]。盆底功能障碍的患者,其盆底组织中胶原的含量明显减少[4-6],胶原蛋白之间的交联明显降低[7]。
成纤维细胞是胶原代谢的主要调控细胞。成纤维细胞能够将多种生长因子、多种激素、细胞素、基质金属蛋白酶(matrix metalloproteinases,MMPs)及其抑制剂(tissue inhibitor of matrix metalloproteinases,TIMPs)合成并分泌出来, 对胶原的合成与分解平衡进行调控, 在细胞新陈代谢和组织重塑中发挥着极为重要的作用[8]。在皮肤、骨与软骨组织、口腔医学等领域,细胞的力学特性研究较多。如研究发现[9],在皮肤组织的成纤维细胞中,细胞拉伸应力使细胞产生的I型胶原蛋白减少而产生的纤连蛋白增加。牙周韧带成纤维细胞中,拉伸应力使细胞的MMP-1、MMP-2、TIMP1、TIMP2的RNA表达水平上调[10]。在膝关节前交叉韧带及侧副韧带的成纤维细胞中,拉伸应力可以增加细胞MMP-2的表达[11]。
盆底领域相关细胞生物力学的研究相对起步较晚。国内有学者研究发现于POP患者的阴道壁成纤维细胞施加应力,随着应力的增加, Collagen I、Collagen Ⅲ、PH4及MMP-2 mRNA的水平均有下降的趋势[12]。骶韧带的成纤维细胞在适当的应力作用下可以促进盆底胶原的合成,应力过大或过小均不利于胶原的合成[13]。有研究发现,对宫旁韧带的成纤维细胞施加过度的应力可以诱发细胞内活性氧(reactive oxygen species,ROS)的产生,加速细胞的凋亡[14]。阴道壁成纤维细胞加载周期性机械力后其细胞凋亡率和 actin 细胞骨架破坏程度增加[15]。
本研究提取了无盆腔脏器脱垂相关疾病且未绝经的女性的宫骶韧带成纤维细胞,施加应力后发现,较小的拉伸应力作用时间较短的情况下,成纤维细胞表现出增殖能力增加的趋势,但是这种差异无显著性。但较大的拉伸应力可以抑制使成纤维细胞的增殖能力;且在一定范围内随着应力增加(6%~12%)及作用时间延长(12~24 h)其抑制作用增加。
此外,本研究检测了应力作用下,成纤维细胞胶原代谢相关基因表达的变化。其中CollagenⅠ及CollagenⅢ 为成纤维细胞合成的胶原成分,MMP-2促进胶原的分解代谢,TIMP2则可以抑制MMP-2的活性,而LOXL1是盆底胶原纤维通过共价交联取得稳定性和发育成熟的关键酶之一。较小的拉伸应力,似乎有促进成纤维细胞胶原基因表达的趋势,但本研究中差异无统计学意义,仍需进一步实验验证。而较大的拉伸应力则导致胶原相关基因mRNA的表达下降。CollagenⅠ及CollagenⅢ的mRNA表达下降,提示成纤维细胞的胶原合成能力下降。同时值得注意的是,虽然MMP-2的表达下降可能导致胶原的分解代谢减弱,但TIMP2的mRNA表达同时下降,且下降的程度更大。同时MMP-2 mRNA的下降具有相对的滞后性。这种变化提示可能胶原的分解代谢受到应力作用影响的程度更小。此外,LOXL1 mRNA表达下降,提示成纤维细胞胶原的稳定性变得更加脆弱。
本研究结果可以推测,在较大的应力作用下,子宫旁韧带的成纤维细胞的增殖能力、胶原生成及稳定成熟的能力受到减弱,成纤维细胞的胶原代谢平衡可能被打破,从而导致盆底的结缔组织的力学特性下降。而这一机制可能参与了盆腔脏器脱垂发生发展的过程。本研究仅为对骶韧带来源的成纤维细胞应力下的细胞特性的初步研究,更深入的研究仍有待进行。
1 于霞, 何丽, 王丽,等.盆腔器官脱垂发病机制的研究进展.中国计划生育和妇产科,2021,13:15-18.
2 Mezzadri M.Physiopathologie des prolapsus génitaux Pelvic organ prolapse physiopathology.Rev Prat,2019 ,69:385-386.
3 Huntington A, Donaldson K, De Vita R.Contractile Properties of Vaginal Tissue.J Biomech Eng, 2020 ,142:080801.
4 Mega Putra IG, Ngurah Warsita IG, Suwiyoga K, et al.Low expression of collagen type-1 in sacrouterine ligament as risk factor of stage III-IV uterine prolapse.Eur J Obstet Gynecol Reprod Biol,2020,249:32-36.
5 Hu Y, Wu R, Li H, et al.Expression and Significance of Metalloproteinase and Collagen in Vaginal Wall Tissues of Patients with Pelvic Organ Prolapse.Ann Clin Lab Sci,2017,47:698-705.
6 Zeng C, Liu J, Wang H,et al.Correlation Between Autophagy and Collagen Deposition in Patients With Pelvic Organ Prolapse.Female Pelvic Med Reconstr Surg,2018,24:213-221.
7 Gong R, Xia Z.Collagen changes in pelvic support tissues in women with pelvic organ prolapse.Eur J Obstet Gynecol Reprod Biol, 2019,234:185-189.
8 Guler Z, Roovers JP.Role of Fibroblasts and Myofibroblasts on the Pathogenesis and Treatment of Pelvic Organ Prolapse.Biomolecules,2022,12:94.
9 单淑芝,石彬,赵昕,等.机械力对盆腔脏器脱垂阴道壁成纤维细胞的影响.实用妇产科杂志,2011,27:665-669.
10 苏瑞,宋立婷,董允允,等.人牙龈成纤维细胞和牙周膜韧带细胞多向分化潜能的比较.天津医药,2016,44:137-141.
11 Cai L, An S, Liao J, et al.Influences of Tumor Necrosis Factor-α on Lysyl Oxidases and Matrix Metalloproteinases of Injured Anterior Cruciate Ligament and Medial Collateral Ligament Fibroblasts.J Knee Surg, 2017,30:78-87.
12 蒋励, 苗娅莉, 张立芳,等.盆腔器官脱垂患者阴道壁成纤维细胞受力后变化特征初步研究.中国妇产科临床杂志,2010,11:37-40.
13 李晓伟, 苗娅莉, 王建六,等.子宫骶韧带成纤维细胞受力后胶原合成变化的初步研究.中华妇产科杂志,2011,46:172-176.
14 Hong S, Li H, Wu D, et al.Oxidative damage to human parametrial ligament fibroblasts induced by mechanical stress.Mol Med Rep,2015,12:5342-5348.
15 李洋,申复进,洪莎莎,等.机械力对女性阴道前壁成纤维细胞骨架及凋亡的影响.现代妇产科进展,2021,30:761-764.