多囊卵巢综合征(polycystic ovary syndrome, PCOS)是育龄期妇女最常见的生殖内分泌疾病,患病率高达7.8%[1],常伴胰岛素抵抗、糖尿病、心血管疾病、肥胖、子宫内膜癌等并发症,严重影响患者生活质量。PCOS的诊断标准不一,但高雄激素血症一直被视为PCOS的重要特征,在PCOS的发病机制研究中,也存在将PCOS视为卵巢源性高雄激素血症的观点[2],表明其在PCOS发生发展中的关键地位。然而,雄激素和相关信号在PCOS及其相关并发症中的实际作用尚未明确。
卵巢雄激素在膜细胞中生成,雄激素过量会对颗粒细胞和卵母细胞产生不良影响,阻碍卵泡发育,导致排卵和卵母细胞成熟障碍、月经紊乱[3-4]。全身性的高雄激素血症会引起多毛和痤疮,加重其糖脂代谢和激素代谢紊乱,同时也被这些代谢异常进一步恶化[5]。因此,研究高雄激素环境下颗粒细胞的生物学功能改变对揭示PCOS发病分子机制,厘清高雄激素和PCOS其他并发症之间的因果关系,提供治疗靶点意义重大。
颗粒细胞在排卵和卵成熟过程中扮演重要角色,既往研究对颗粒细胞功能障碍的机制筛选多局限在PCOS女性与对照受试者颗粒细胞转录组之间的对比[6-8],缺乏关于雄激素对颗粒细胞转录组影响的研究,不利于探讨卵巢局部雄激素过量这一因素本身如何影响卵巢功能。本研究通过对比体外高雄激素与非高雄激素环境下小鼠颗粒细胞的转录组信息,旨在对高雄损害卵巢颗粒细胞功能的分子机制进行全面筛查和讨论。
对象与方法
一、对象
实验动物为SPF级3 周龄C57/BL6 J健康雌鼠,购于北京大学医学部实验动物科学中心,实验方案获得北京大学伦理委员会审核批准。
二、方法
1. 小鼠颗粒细胞获取及培养:取材前48 h对小鼠行5~10 IU PMSG腹腔注射以促进卵泡发育。取材时断颈处死小鼠,取双卵巢经PBS清洗后转移到37℃的M2培养基中,体式镜下刺破卵泡,排出颗粒细胞。口吸管收集颗粒细胞后25℃ 2 000 rpm离心5 min. 弃上清,用PBS重悬洗1~2 次后加入含10% FBS和1% P/S的DMEM/F12培养基,将细胞接种至12孔板中,8~12 h贴壁后换液,DHEA组加10 μM DHEA处理6 h,对照组加入等量DMSO。
2. 总RNA提取:弃去原培养基,PBS清洗1~2 次后Trizol法提取RNA。
3. 文库构建与测序:RNA质检合格后取1 μg构建文库。使用Oligo(dT)珠子分离poly(A) mRNA,在二价阳离子和高温条件下进行mRNA片段化。采用随机引物合成了第一链和第二链cDNA。纯化双链cDNA后修复两端,连接一个dA尾,用T-A连接以在两端添加接头序列。然后使用DNA清洁珠子对接头序列连接的DNA进行大小选择。采用P5和P7引物进行PCR扩增,并对PCR产物进行验证。然后,将具有不同索引的文库多路复用,在Illumina HiSeq/ Illumina NovaSeq/ MGI2000仪器上,根据制造商的说明,使用2x150双端(PE)配置进行测序。
4. 数据分析:主成分分析用R(Version 3.0.3) ggplot2包分析绘制。差异表达分析用DESeq2 Bioconductor包,多重假设检验校正后的Padj<0.05被视为有显著差异。GOSeq(v1.34.1)用于识别基因本体(gene ontology, GO)术语,注释显著富集的基因。京都基因和基因组百科全书(Kyoto Encylopaedia of Genes and Genomes, KEGG)是一个涉及基因组、生物途径、疾病、药物和化学物质的数据库集合(http://en.wikipedia.org/wiki/KEGG)。本研究使用其中的脚本在KEGG通路中富集显著差异表达基因。GSEA分析借助GSEA数据库完成(http://www.gsea-msigdb.org/gsea/index.jsp),参考hallmark基因集,对通路内有标识的基因使用加权法计算富集分数(enrichment score, ES),标准化后得到标准化的富集分数(normalized enrichment score, NES);通过计算错误发现率(false discovery rate, FDR) 控制假阳性率。富集结果满足FDR<0.25,P<0.05且|NES|>1表示结果有统计学意义。
结 果
一、主成分分析和基因差异表达分析
主成分分析(principal component analysis, PCA)可以降低数据的复杂性,深入挖掘样品之间关系和变异大小,展示样本间的聚类关系。在两组小鼠颗粒细胞的主成分分析中,可以看到在组内差异不大的情况下,两组样品明显地聚为两类(N=3),表明数据重复性良好。见图1。
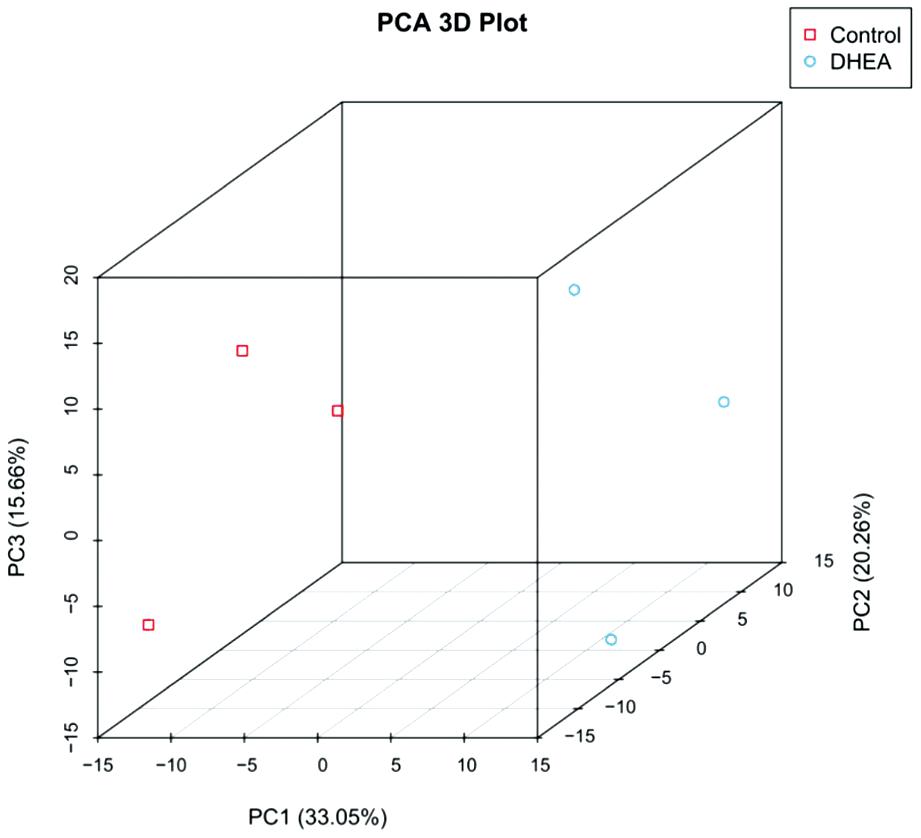
图1 3D主成分分析
Figure 1 3D principal component analysis
对两组样品基因表达情况按差异显著性标准(Fold Change≥2且q value(FDR, Padj)≤0.05)进行筛选,可发现DHEA处理组的颗粒细胞相较于对照组有355 个基因显著下调(图2中用蓝色标记的点),577 个基因显著上调(图2中用红色标记的点),组间差异明显(图2),说明DHEA处理对小鼠颗粒细胞基因表达产生了广泛影响。
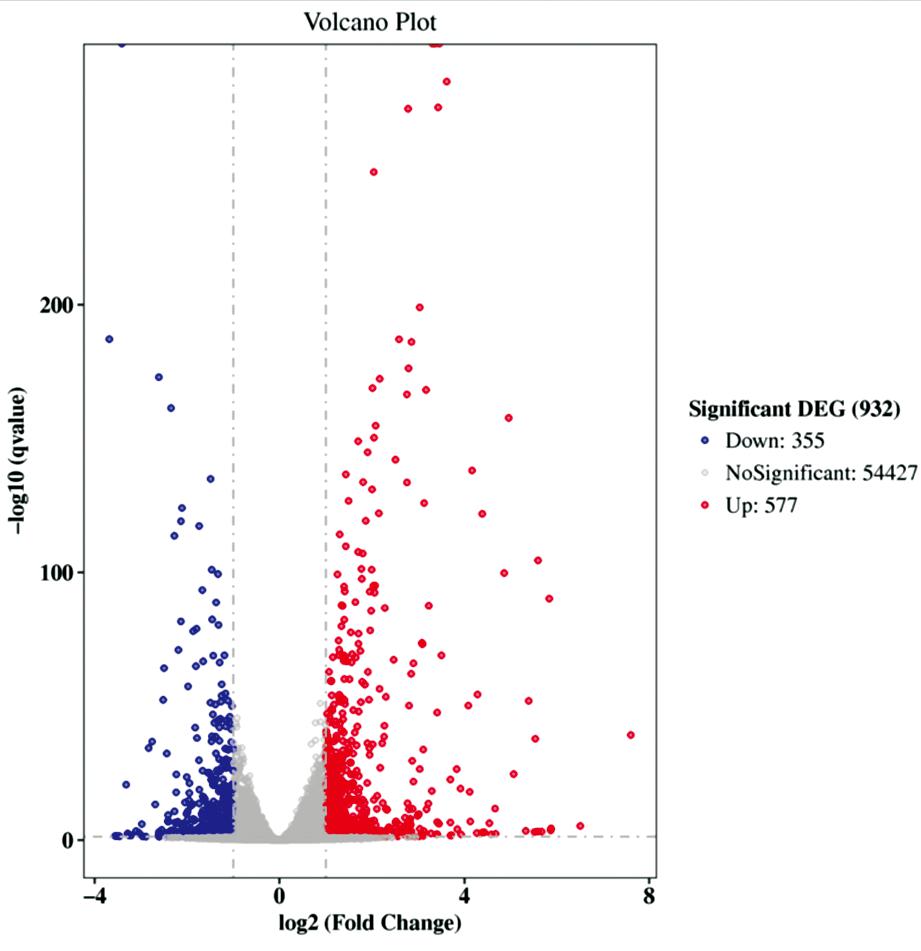
图2 差异基因火山图
Figure 2 Volcano map of differential genes
二、GO和KEGG富集分析
为探究这些表达差异基因的生物学功能,本研究对表达差异具有显著性的基因进行了GO和KEGG富集分析。GO将基因功能分为分子功能(molecular function, MF)、细胞组分(cellular component, CC)、参与的生物过程(biological process, BP)三类,从这三个角度说明两组样本间有显著差异的基因影响了细胞中什么位置的哪些细胞功能。MF富集最显著的GO条目依次是:蛋白质结合、蛋白质同二聚体活性、蛋白质激酶结合、微管结合、激素活性、谷硫酮转移酶活性、配体激活的序列特异性DNA结合RNA聚合酶Ⅱ转录因子活性、谷胱甘肽结合。CC富集最显著的GO条目依次是:膜的整体成分、细胞质、细胞外间隙、细胞外区域、神经元细胞体、细胞表面、细胞骨骼、顶端质膜、蛋白样细胞外基质、质膜外侧、结合珠蛋白-血红蛋白复合物。BP富集最显著的GO条目依次是:细胞分裂、细胞凋亡过程的正向调节、有丝分裂、蛋白激酶B信号通路的正向调节、对机械刺激的反应、氨基酸跨膜转运、细胞内受体信号通路、谷胱甘肽代谢过程、异种分解代谢过程、睾酮生物合成过程、细胞外基质成分分泌的正向调节。见图3。
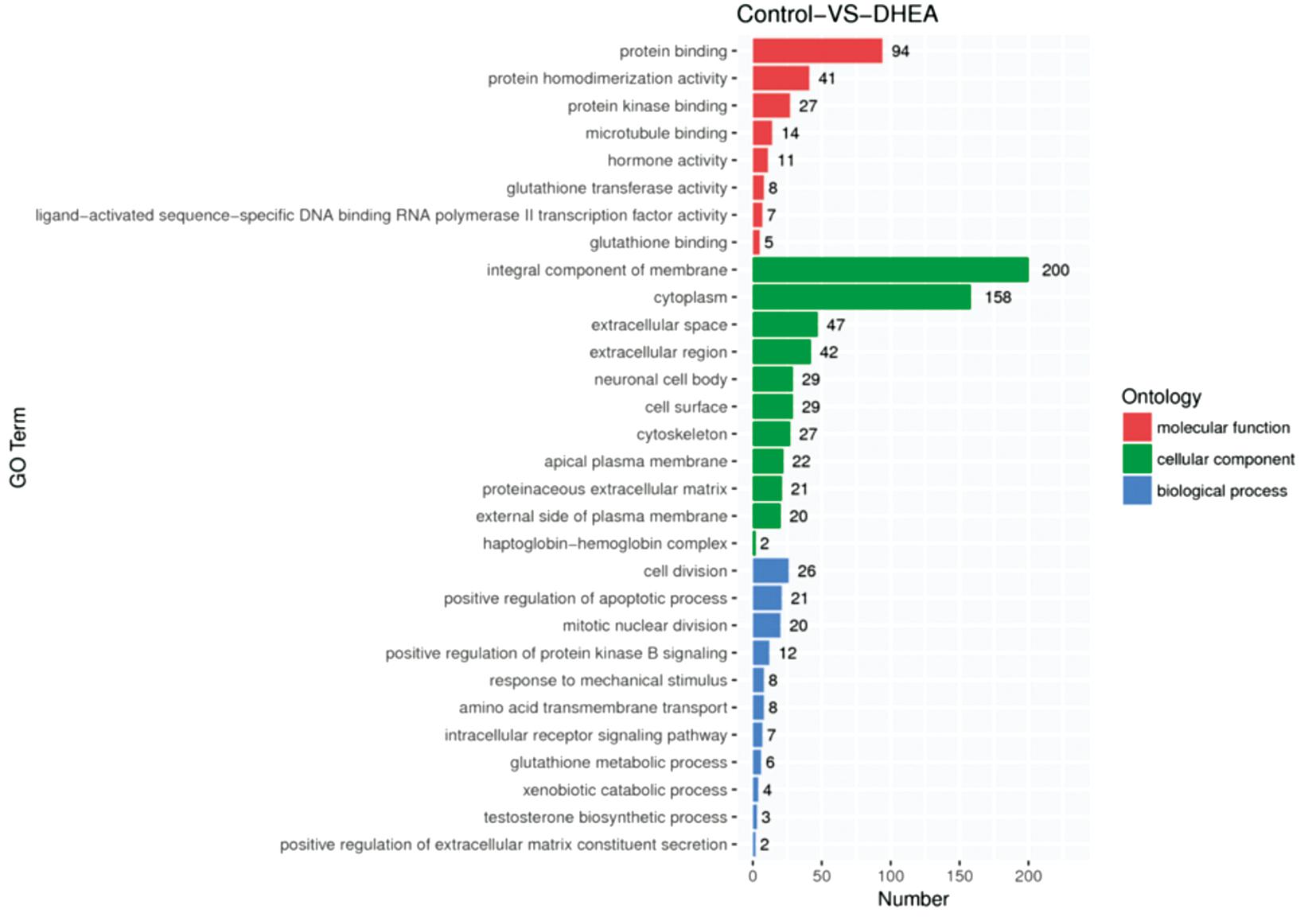
图3 富集程度前30的GO条目
Figure 3 The top 30 enriched GO items
对DHEA组和对照组表达差异具有显著性的基因进行KEGG通路分析,可以了解两组样本间表达差异显著的基因分布在哪些通路相关的基因集中。如图4所示,KEGG分析结果富集到过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPAR)信号通路、肾素分泌、细胞色素P450药物代谢、谷胱甘肽代谢、甘氨酸、丝氨酸和苏氨酸代谢、精氨酸生物合成、单环β-内酰胺类抗生素生物合成、在癌症中的通路、胰岛素抵抗、环磷酸腺苷(cyclic adenosine monophosphate, cAMP)信号通路等。
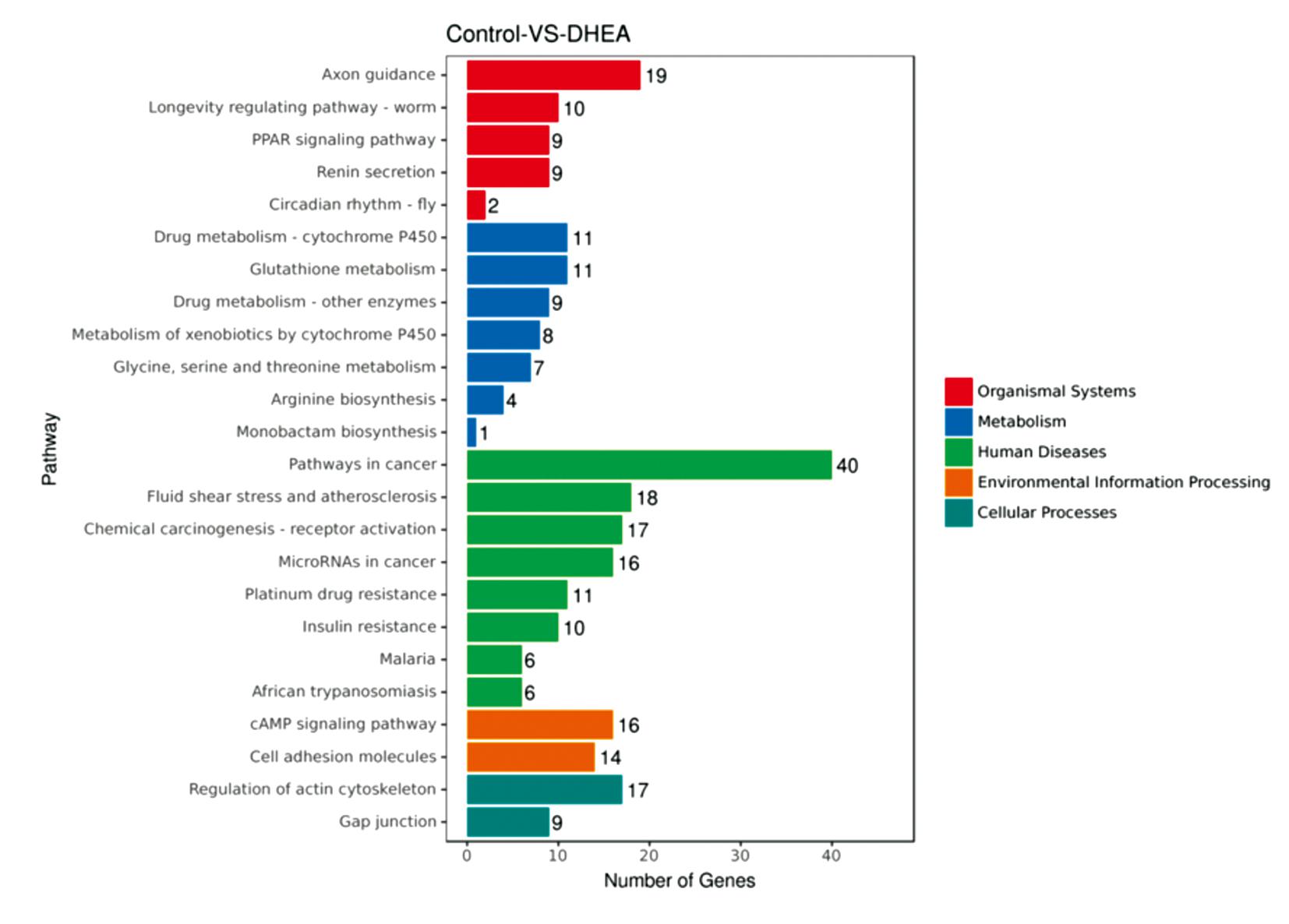
图4 富集最显著的KEGG通路
Figure 4 The most significantly enriched KEGG pathways
三、GSEA分析
GO与KEGG一方面仅仅富集FoldChange与p value同时变化显著的基因,可能漏掉变化倍数不大但功能重要的基因;另一方面只能指出哪些通路变化显著,不能回答通路具体是被激活还是被抑制的问题。而基因集富集分析(gene set enrichment analysis, GSEA)不预先在表达差异显著的基础上对基因进行过滤,作为GO和KEGG的补充能更全面地对比两组样本间通路的抑制激活情况。
与对照组相比,DHEA组中激活最显著的14 个基因集如表1所示,其中E2F转录因子靶点通路,G2M检查点,MYC靶基因V2,MYC靶基因V1,MTORC1信号,未折叠蛋白响应富集最显著(FDR q value<0.25)。其次是有丝分裂纺锤体,活性氧途径,胆固醇平衡,血红素代谢,雄激素响应,晚期雌激素反应,早期雌激素反应和氧化磷酸化(NOM p value<0.25),说明DHEA激活了小鼠颗粒细胞中的这些生物学活动。而在对照组中显著富集的基因集只有上皮间质转化(表2),即DHEA抑制了小鼠颗粒细胞的上皮间质转化。
表1 DHEA组中显著富集的基因集
Table 1 Gene sets significantly enriched in phenotype DHEA
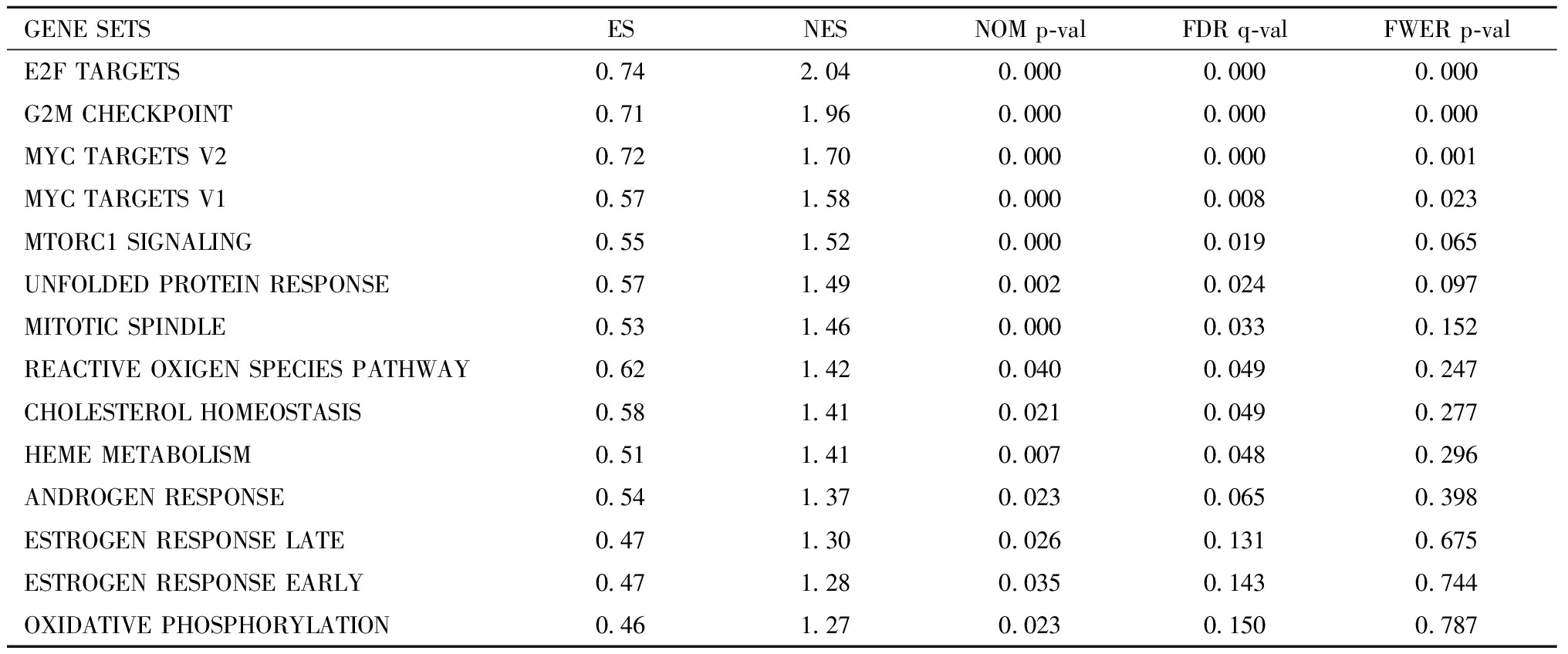
GENE SETSESNESNOM p-valFDR q-valFWER p-valE2F TARGETS0.742.040.0000.0000.000G2M CHECKPOINT0.711.960.0000.0000.000MYC TARGETS V20.721.700.0000.0000.001MYC TARGETS V10.571.580.0000.0080.023MTORC1 SIGNALING0.551.520.0000.0190.065UNFOLDED PROTEIN RESPONSE0.571.490.0020.0240.097MITOTIC SPINDLE0.531.460.0000.0330.152REACTIVE OXIGEN SPECIES PATHWAY0.621.420.0400.0490.247CHOLESTEROL HOMEOSTASIS0.581.410.0210.0490.277HEME METABOLISM0.511.410.0070.0480.296ANDROGEN RESPONSE0.541.370.0230.0650.398ESTROGEN RESPONSE LATE0.471.300.0260.1310.675ESTROGEN RESPONSE EARLY0.471.280.0350.1430.744OXIDATIVE PHOSPHORYLATION0.461.270.0230.1500.787
NES:enrichment score; NOM p-val:nominal P value; FDR q-val:false discovery rate q value; FWER p-val:family-wise error rate p value
表2 Control组中富集到的GSEA基因集
Table 2 Gene sets enriched in phenotype Control
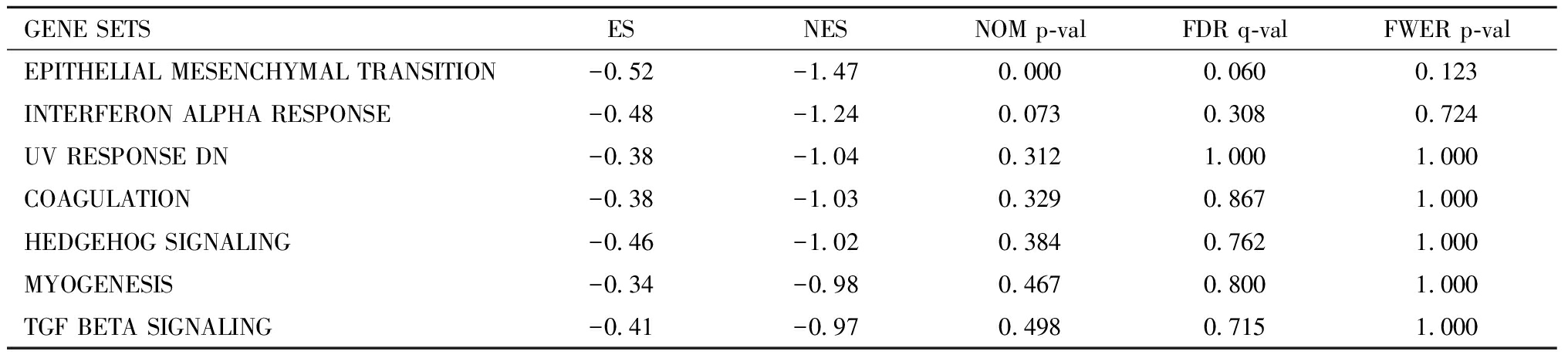
GENE SETSESNESNOM p-valFDR q-valFWER p-valEPITHELIAL MESENCHYMAL TRANSITION-0.52-1.470.0000.0600.123INTERFERON ALPHA RESPONSE-0.48-1.240.0730.3080.724UV RESPONSE DN-0.38-1.040.3121.0001.000COAGULATION-0.38-1.030.3290.8671.000HEDGEHOG SIGNALING-0.46-1.020.3840.7621.000MYOGENESIS-0.34-0.980.4670.8001.000TGF BETA SIGNALING-0.41-0.970.4980.7151.000
讨 论
一、颗粒细胞凋亡导致卵巢功能障碍
在PCOS模型中,随着卵泡发育至窦卵泡阶段,颗粒细胞凋亡率逐渐增加,大量卵泡发育停滞不前,形成卵巢多囊样改变。颗粒细胞通过缝隙连接与卵母细胞紧密联系[9],其凋亡还会影响卵母细胞成熟[10]。卵巢雄激素过量对颗粒细胞凋亡的诱导作用逐渐受到认可[11]。在本研究中,KEGG显著富集到的癌症中的通路,以及GSEA分析中被显著激活的E2F靶点通路,G2M检查点,MYC靶基因V2,MYC靶基因V1也都指向了DHEA影响颗粒细胞的机制与凋亡有关。E2F主要以细胞周期依赖性的方式调节与细胞增殖、凋亡和分化相关的几个基因的表达 [12-13]。由原癌基因c-MYC编码的MYC是细胞转录的重要调节因子,高 MYC水平可引发细胞凋亡[14],而卵巢组织中c-MYC的表达降低有利于改善小鼠的PCOS表型[15]。当前对PCOS颗粒细胞凋亡引发机制的研究多集中在自噬方面[16],而本研究的测序结果则主要强调了氧化应激与炎症在其中的作用。
二、氧化应激与炎症引发颗粒细胞凋亡
PCOS患者卵巢局部存在慢性低度炎症状态,影响正常卵巢功能[17]。同时PCOS患者表现出明显的氧化应激,有研究表明高雄诱导的氧自由基产生可能是这其中的原因[18]。氧化应激与炎症反应在PCOS的发病过程中同为病因,互为因果。在本研究中,GO和KEGG富集结果显示PPAR信号通路、谷胱甘肽代谢、精氨酸生物合成、单环β-内酰胺类抗生素生物合成、cAMP信号通路在DHEA处理后发生了显著变化。GSEA提示DHEA激活了小鼠颗粒细胞中的mTORC1信号,未折叠蛋白响应、活性氧途径、氧化磷酸化;抑制了上皮间质转化。上述生物学过程和信号通路均与氧化应激和炎症相关,强调了氧化应激和炎症在高雄激素引起颗粒细胞功能损伤中的重要作用。
PPAR作为核激素受体,其中的过氧化物酶体增殖物激活受体γ(PPARγ)不仅与PCOS患者中降低的IL-7,升高的IL-1β,IL-6和TNFα水平有直接关联[19],被激活后还可改善高雄激素型PCOS患者的代谢和生殖表型[20]。谷胱甘肽作为体内重要的抗氧化剂,能保护人体免受自由基和促氧化剂的伤害,参与调节蛋白质折叠和细胞凋亡[21]。过量的雄激素可能通过影响谷胱甘肽来促进颗粒细胞凋亡,诱发卵泡过早闭锁[22],这与本研究中GO和KEGG的提示相吻合。精氨酸在甲基化过程中发挥重要作用,参与精氨酸合成过程的9 种精氨酸甲基转移酶可通过广泛途径参与氧化应激和炎症[23]。目前的研究表明,PCOS患者的精氨酸代谢可能受到影响,但可能由于样本大小或患者特征的不同,对PCOS患者精氨酸代谢变化及作用的研究结论多有龃龉,需要更多的大样本研究验证[24-26]。cAMP是最通用的细胞第二信使之一,调节促炎细胞因子和粒细胞招募,控制粒细胞凋亡和吞噬作用[27]。上述通路在本研究中虽被GO或KEGG富集,却未在GSEA分析中表现出明显的激活或抑制趋势,因此只能说明它们在PCOS中确实发生了变化,但具体变化趋势还不能明确。
mTORC1 与mTORC2同属丝氨酸/硫氨酸激酶,有研究报道mTORC1在PCOS中被显著激活[28],这与本研究中的发现一致,说明PCOS中mTORC1的激活可能是由雄激素过剩导致的。另有研究发现mTOR通路被二甲双胍抑制后能清除产生TNFα的B细胞[29],这同时强调了PCOS患者过量的雄激素对炎症的促进关系[17]。此外,mTORC1激活还会造成线粒体损伤,降低葡萄糖转运蛋白4(glucose transporter 4, GLUT4)表达,下调葡萄糖摄取,导致骨骼肌胰岛素抵抗[30]。最后,颗粒细胞需要进行上皮间质转化才能完成正常排卵过程[31],GSEA提示DHEA抑制了小鼠颗粒细胞中的上皮间质转化,这或许是高雄激素抑制排卵的另一原因。
三、创新性与研究局限
高雄激素对PCOS卵巢局部的作用及其与PCOS其他并发症之间的关系尚未阐明,既往研究中仅有两例关注了雄激素过量单独对颗粒细胞的影响[32-33],但其高通量测序内容主要局限于基于差异基因进行的富集分析,没有进行更高级的数据分析;同时只就研究者的关注重点进行了验证,数据解读不够全面。而本研究借助GSEA这个更高级且不预先设置表达差异显著性门槛的方法,说明了各个通路的抑制或激活情况,客观分析其整体变化情况后着重强调了氧化应激与炎症在雄激素影响颗粒细胞功能中的权重。尽管本研究反映的是颗粒细胞在体外对雄激素DHEA的短期应答,与人体中长期高雄激素环境下颗粒细胞的基因表达变化是否一致还有待证实,有一定的研究局限性,但也部分解读了高雄激素在转录组水平对小鼠颗粒细胞产生的影响,指出了氧化应激与炎症在高雄激素引发的PCOS颗粒细胞功能障碍中的重要作用,可作为后续分子机制研究的重要参考。
1 Rui Y,Qin L,Zehong Z,et al.Changes in the prevalence of polycystic ovary syndrome in China over the past decade.Lancet Reg Health West Pac,2022,25:100494.
2 Rosenfield RL,Ehrmann DA.The Pathogenesis of Polycystic Ovary Syndrome (PCOS):The Hypothesis of PCOS as Functional Ovarian Hyperandrogenism Revisited.Endocr Rev,2016,37:467-520.
3 Wenting Y,Tingting X,Yali S,et al.The role of androgen and its related signals in PCOS.J Cell Mol Med,2021,25:1825-1837.
4 Bertoldo MJ,Caldwell ASL,Riepsamen AH,et al.A Hyperandrogenic Environment Causes Intrinsic Defects That Are Detrimental to Follicular Dynamics in a PCOS Mouse Model.Endocrinology,2019,160:699-715.
5 Xin Z,Yuanjie X,Yating L,et al.Polycystic ovarian syndrome:Correlation between hyperandrogenism,insulin resistance and obesity.Clin Chim Acta,2020,502:214-221.
6 Zanjirband M,Baharlooie M,Safaeinejad Z,et al.Transcriptomic screening to identify hub genes and drug signatures for PCOS based on RNA-Seq data in granulosa cells.Comput Biol Med,2023,154:106601.
7 Zhanrui M,Ting L,Hui Z,et al.Identification of epigenetic interactions between microRNA and DNA methylation associated with polycystic ovarian syndrome.J Hum Genet,2021,66:123-137.
8 Mackeh R,Boughorbel S,Chaussabel D,et al.-A curated transcriptomic dataset collection relevant to embryonic development associated with in vitro fertilization in healthy individuals and patients with polycystic ovary syndrome.F1000Res,2017,6:181.
9 Dell′Aquila ME,Albrizio M,Maritato F,et al.Meiotic competence of equine oocytes and pronucleus formation after intracytoplasmic sperm injection (ICSI) as related to granulosa cell apoptosis.Biol Reprod,2003,68:2065-2072.
10 Høst E,Gabrielsen A,Lindenberg S,et al.Apoptosis in human cumulus cells in relation to zona pellucida thickness variation,maturation stage,and cleavage of the corresponding oocyte after intracytoplasmic sperm injection.Fertil Steril,2002,77:511-515.
11 Abolghasemi M,Mahjoub S.Long noncoding RNAs as a piece of polycystic ovary syndrome puzzle.Mol Biol Rep,2021,48:3845-3851.
12 Kassab A,Gupta I,Moustafa AA.Role of E2F transcription factor in oral cancer:Recent insight and advancements.Semin Cancer Biol,2023,92:28-41.
13 Kent LN,Leone G.The broken cycle:E2F dysfunction in cancer.Nat Rev Cancer,2019,19:326-338.
14 García-Gutiérrez L,Delgado MD,León J.MYC Oncogene Contributions to Release of Cell Cycle Brakes.Genes (Basel),2019,10:244.
15 Yuwei Z,Haili Z,Caifei D.The ameliorative effect of CangFu Daotan Decoction on polycystic ovary syndrome of rodent model is associated with m6A methylation and Wnt/β-catenin pathway.Gynecol Endocrinol,2023,39:2181637.
16 Kumariya S,Ubba V,Jha RK,et al.Autophagy in ovary and polycystic ovary syndrome:role,dispute and future perspective.Autophagy,2021,17:2706-2733.
17 Yi Z,Yanli P.Systemic and ovarian inflammation in women with polycystic ovary syndrome.J Reprod Immunol,2022,151:103628.
18 Savic′-Radojevic′ A,Mažibrada I,Djukic′ T,et al.Glutathione S-transferase (GST) polymorphism could be an early marker in the development of polycystic ovary syndrome (PCOS) - an insight from non-obese and non-insulin resistant adolescents.Endokrynol Pol,2018,69:366-374.
19 Knebel B,Janssen OE,Hahn S,et al.Increased low grade inflammatory serum markers in patients with Polycystic ovary syndrome (PCOS) and their relationship to PPARgamma gene variants.Exp Clin Endocrinol Diabetes,2008,116:481-486.
20 Macut D,Mladenovic′ V,Bjekic′-Macut J,et al.Hypertension in Polycystic Ovary Syndrome:Novel Insights.Curr Hypertens Rev,2020,16:55-60.
21 Averill-Bates DA.The antioxidant glutathione.Vitam Horm,2023,121:109-141.
22 Xuemei Q,Youhua W,Chengwen L,et al.Hyperandrogen enhances apoptosis of human ovarian granulosa cells via up-regulation and demethylation of PDCD4.Gynecol Endocrinol,2020,36:333-337.
23 Ting C,Jinxin L,Shizhe L,et al.The role of protein arginine N-methyltransferases in inflammation.Semin Cell Dev Biol,2024,154:208-214.
24 Kyselova A,Hinrichsmeyer H,Zukunft S,et al.Association between arginase-containing platelet-derived microparticles and altered plasma arginine metabolism in polycystic ovary syndrome.Metabolism,2019,90:16-19.
25 Ragy MM,Abdel-Hamid HA,Toni N.Pathophysiological changes in experimental polycystic ovary syndrome in female albino rats:Using either hemin or L-arginine.J Cell Physiol,2019,234:8426-8435.
26 Masha A,Manieri C,Dinatale S,et al.Prolonged treatment with N-acetylcysteine and L-arginine restores gonadal function in patients with polycystic ovary syndrome.J Endocrinol Invest,2009,32:870-872.
27 Tavares LP,Negreiros-Lima GL,Lima KM,et al.Blame the signaling:Role of cAMP for the resolution of inflammation.Pharmacol Res,2020,159:105030.
28 Ailing L,Hongqing L,Zhiliang L,et al.New Insights into mTOR Signal Pathways in Ovarian-Related Diseases:Polycystic Ovary Syndrome and Ovarian Cancer.Asian Pac J Cancer Prev,2016,17:5087-5094.
29 Na X,Jie W,Ting W,et al.Metformin abrogates pathological TNF-α-producing B cells through mTOR-dependent metabolic reprogramming in polycystic ovary syndrome.Elife,2022,11:e74713.
30 Xi S,Qiyang S,Liting F,et al.Dehydroepiandrosterone-induced activation of mTORC1 and inhibition of autophagy contribute to skeletal muscle insulin resistance in a mouse model of polycystic ovary syndrome.Oncotarget,2018,9:11905-11921.
31 Qin Z,Mulin L,Juan F.ALG2 inhibits the epithelial-to-mesenchymal transition and stemness of ovarian granulosa cells through the Wnt/β-catenin signaling pathway in polycystic ovary syndrome.Reprod Biol,2022,22:100706.
32 Bishop CV,Reiter TE,Erikson DW,et al.Chronically elevated androgen and/or consumption of a Western-style diet impairs oocyte quality and granulosa cell function in the nonhuman primate periovulatory follicle.J Assist Reprod Genet,2019,36:1497-1511.
33 Roy S,Binbin H,Sinha N,et al.Androgens regulate ovarian gene expression by balancing Ezh2-Jmjd3 mediated H3K27me3 dynamics.PLoS Genet,2021,17:e1009483.