染色体非整倍体是指染色体数目非整体性的增加或减少,而呈个别染色体数目的变化[1]。常见的胎儿染色体非整倍体有21-三体、18-三体、13-三体和性染色体非整倍体,其余的可定义为罕见常染色体非整倍体(rare autosomal aneuploidies, RAAs)[2-3]。染色体非整倍体对胎儿发育有不良影响,包括流产、胎儿结构异常及神经发育延迟[4],不同的染色体数目异变对胎儿发育的影响可能不同。目前对常见的染色体非整倍体如21-三体、18-三体和13-三体的研究比较多[5],但对RAAs的研究比较少。本研究回顾近三年来在内蒙古自治区妇幼保健院就诊且确诊为RAAs的病例,分析了RAAs对胎儿发育的影响,为RAAs孕妇的遗传咨询提供理论依据并提升孕妇对RAAs的认知。
对象与方法
1.研究对象:收集2018年8月至2021年9月于内蒙古自治区妇幼保健院进行染色体微阵列(chromosomal microarray analysis,CMA)、荧光原位杂交(fluorescence in situ hybridization,FISH)或羊水染色体核型分析确诊为RAAs的患者共193例,其中经CMA发现126例,样本类型分别为绒毛和羊水;FISH发现65例,样本类型为绒毛;染色体核型分析发现2例,样本类型为羊水。
分别按以下项目分组研究胎儿存活孕周、孕妇妊娠结局与RAAs的关系。孕期:按末次月经或B超计算得到孕周,其孕早期为孕周<13周,孕中期为怀孕13~28周,晚期为孕周>28周[6];妊娠结局分为流产和非流产。流产根据自然流产发展的不同阶段分为先兆流产、难免流产、不全流产和完全流产;稽留流产、复发性流产和流产合并感染是三种特殊类型的自然流产,诊断标准参照谢辛主编的第九版《妇产科学》[7];非流产组包括引产和成功分娩。
RAAs纳入标准:经CMA/FISH/羊水染色体核型分析确诊为RAAs的患者;排除标准:本人近期接受过移植手术、异体输血、异体细胞治疗或检测失败者;临床信息不全或拒绝随访的患者。
2. 方法:
(1)标本采集。羊水标本:一次性抽取羊水量25~35 mL用于CMA和染色体核型分析。采集时为防止母源污染,弃去最初的1~2 mL并更换注射器。标本要求新鲜、清亮无浑浊、无胎粪、无凝块且无母血污染(血性羊水),可疑母源污染的标本需进行羊水细胞培养,待细胞贴壁后,除去悬浮红细胞,使用细胞刮或胰酶消化后取贴壁羊水细胞,经生理盐水冲洗后,再用于全基因组DNA提取;绒毛标本:采集20 mg左右用于CMA和FISH,经生理盐水充分洗涤后,于显微镜下分离蜕膜和血凝块。
(2)染色体微阵列技术。使用 Promega公司(美国)DNA 提取试剂盒对绒毛组织/胎盘组织/羊水细胞进行全基因组DNA提取。再应用Thermo fisher公司(美国)CytoScanTM 750K芯片进行检测,标本依次进行酶切、连接、PCR、纯化、片段化、标记、杂交洗涤、扫描和分析等,检测染色体数目异常。CMA检测提示母体细胞污染超过30%的样本被排除在外[8]。
(3)荧光原位杂交技术。取经染色体制备过程处理的羊水细胞/绒毛组织滴片,标本依次进行烤片、洗涤、消化、脱水、加探针,76摄氏度变性7 min后迅速置于37摄氏度水浴箱中,取出后杂交,DAPI染色,封片,在荧光显微镜下阅片,随机计数50个强信号且无重叠的杂交细胞。结果判读:镜下阅片若大于 90% 的核型显示非整倍体信号则判断为异常。若10%~60%的核型显示非整倍体信号则判断为嵌合体。如果无法判断则扩大计数100个细胞。
(4)羊水染色体核型分析。使用羊膜腔穿刺术抽取羊水20 mL,离心后接种于常规培养基,收获细胞,制片,G显染。镜下计数25个分裂相,至少分析5个分裂相,如异常则增加分裂相分析数目。根据国际人类染色体命名的国际体制(ISCN2016)标准确定染色体核型[9]。
(5)统计学方法。使用SPSS23.0统计软件分析,计数资料用例数(n)或百分比(%)表示,组间比较使用Fisher确切概率法,以P≤0.05为差异有统计学意义。
结果
1.完全型RAAs与嵌合型RAAs妊娠结局比较分析:193例RAAs胎儿中,190例结局为流产,其中一般流产2例,稽留流产188例;3例未发生流产,其中2例引产,1例成功分娩。统计不同RAAs分娩情况,分析孕妇妊娠结局,结果显示,RAAs一般流产发生率低于稽留流产,分别为1.0%和97.4%。其中完全型RAAs与嵌合型RAAs一般流产发生率分别为0.6%和3.3%,稽留流产发生率分别为99.4%和86.7%。两组一般流产发生率无显著性差异(P>0.05),稽留流产发生率差异有统计学意义,完全型RAAs稽留流产发生率高于嵌合型RAAs。仅有3例嵌合型RAAs未发生流产,染色体嵌合比例分别为2号三体嵌合44%、16号三体嵌合38%和20号三体嵌合25%。见表1。
表1 RAAs胚胎/胎儿流产情况 [例(%)]
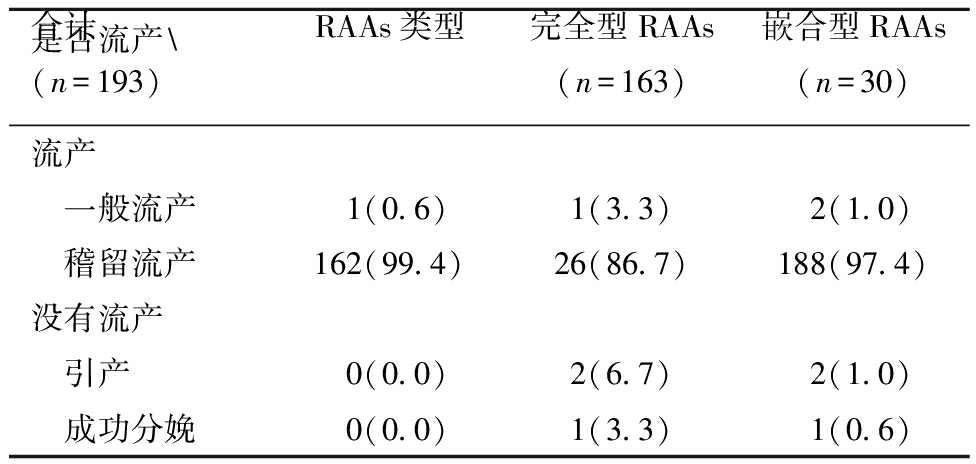
是否流产\RAAs类型完全型RAAs(n=163)嵌合型RAAs(n=30)合计(n=193)流产 一般流产1(0.6)1(3.3)2(1.0) 稽留流产162(99.4)26(86.7)188(97.4)没有流产 引产0(0.0)2(6.7)2(1.0) 成功分娩0(0.0)1(3.3)1(0.6)
2.RAAs分布情况:共收集193例RAAs胎儿,其中完全型RAAs占比84.5%(163/193),嵌合型RAAs占比15.5%(30/193),均为三体或三体嵌合体,未发现单体。本次收集的病例中,RAAs涉及16条染色体,包括2、3、4、5、6、7、8、9、10、11、12、14、15、16、20、22号染色体。其中,最常见的是16号染色体,异常检出率为43.0%(83/193);其次是22号和15号染色体,异常检出率为24.4%(47/193)和9.3%(18/193)。双重三体检出率为3.6%(8/193),分别是5号合并21号(1/8)、18号合并20号(1/8)、16号合并22号(2/8)、16号合并21号(1/8)、9号合并22号(1/8)、16号合并X(1/8)和20号合并Y(1/8)。未发现1、17、19号RAAs,详见图1。
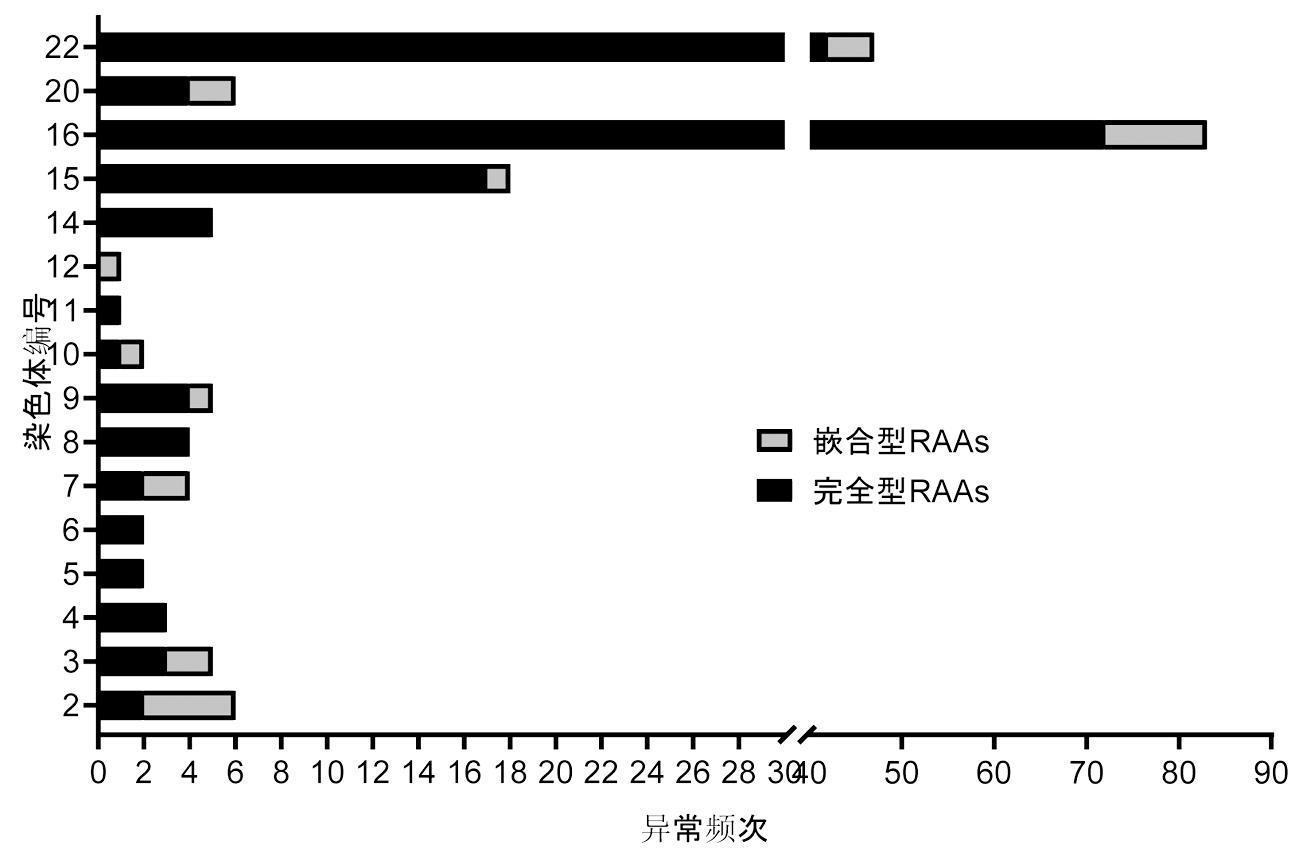
图1 不同RAAs异常发生频次
3.RAAs胚胎/胎儿的流产孕周分析:通过统计不同RAAs流产时的孕周情况,分析胚胎/胎儿发育的孕周跨度。结果显示,所涉及16条RAAs均可在孕早期发生流产,16号染色体发生流产的孕周最早,为第6周;其次是3号与15号染色体,最早流产孕周为7周,其余多数染色体(13/16)发生流产的最早孕周为8~9周,在完全型RAAs中,4、14、15和16号染色体可发育到中孕期的13~14周,9号和22号染色体可发育到更晚,最大为18周。在嵌合型RAAs中,多数RAAs(7/10)胎儿不能发育到孕中期,在孕早期即流产,可发育到的最大孕周为10周,部分(3/10)嵌合型RAAs可发育到较大孕周,16号和20号染色体可发育到19周,2号染色体发育到37周+。详见表2。
表2 完全型RAAs与嵌合型RAAs胚胎/胎儿发育孕周分布情况
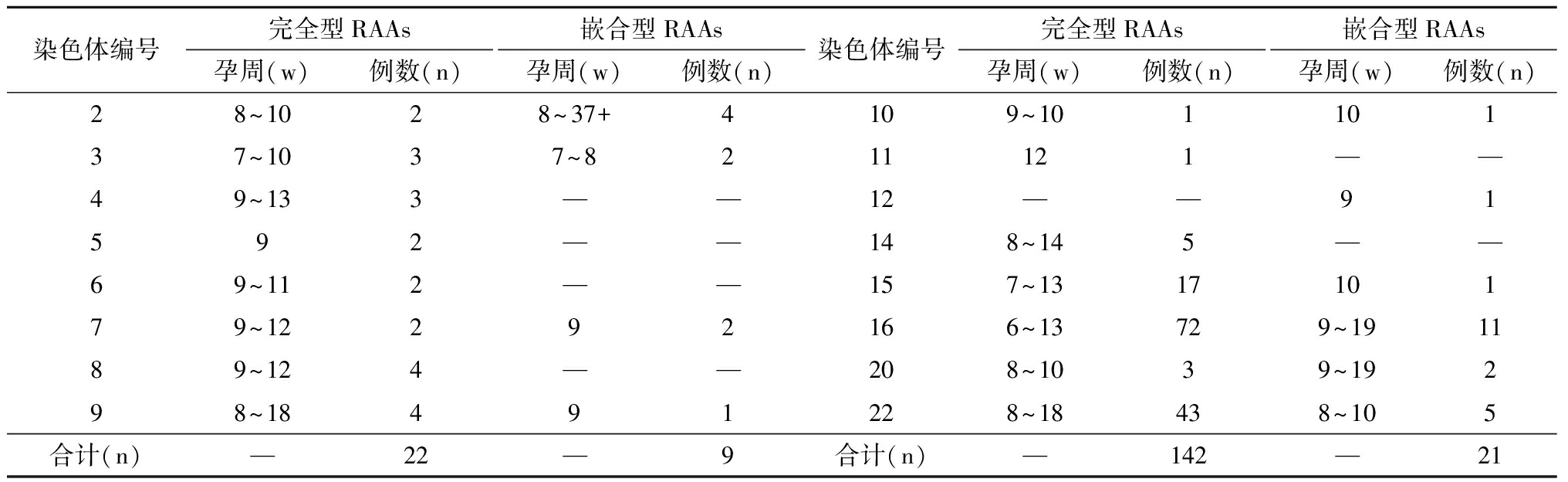
染色体编号完全型RAAs孕周(w)例数(n)嵌合型RAAs孕周(w)例数(n)染色体编号完全型RAAs孕周(w)例数(n)嵌合型RAAs孕周(w)例数(n)28~1028~37+4109~10110137~1037~8211121——49~133——12——91592——148~145——69~112——157~131710179~12292166~13729~191189~124——208~1039~19298~18491228~18438~105合计(n)—22—9合计(n)—142—21
讨论
染色体异常是遗传病常见的病因之一,其中数目异常发生率最高,约占染色体异常的90%[10-11],多数数目异常可能会导致胎死宫内、胎儿生长受限、流产、影响胎儿发育、智力、行为和生长发育落后等疾病。研究显示,流产中染色体异常占50~70%[12-14],其中RAAs可占60%以上[14]。流产在自然妊娠中的发生率约为10%~15%[16]。在本研究中,RAAs胚胎/胎儿一般流产和稽留流产发生率分别为1.0%和97.4%。完全型RAAs与嵌合型RAAs一般流产发生率无显著性差异,两者稽留流产发生率有显著性差异,完全型RAAs稽留流产发生率高于嵌合型RAAs。稽留流产又称胚胎停育,指胚胎或胎儿死亡后滞留宫腔内未及时自然排出[17],可能会引起弥散性血管内凝血(disseminated intravascular coagulation,DIC),多次发生可发展为复发性流产(recurrent spontaneous abortion,RSA),严重影响孕妇的身心健康[18]。因此,对胎儿为RAAs的妇女,应考虑稽留流产的可能,尤其对胎儿为完全型RAAs的妇女,应给予高度关注。此外,本研究未发现RAAs胚胎或胎儿存在复发性流产和流产合并感染结局。Carlo等[19-20]报道复发性流产妇女比正常怀孕妇女更容易发生染色体异常,且两者差异有统计学意义;钟汉威等[21]报道流产合并感染主要与生殖道感染、不洁性生活和人工流产密切相关,推测本研究病例中未发现复发性流产结局的原因可能是样本量少,而流产合并感染的可能原因是其发病机制与染色体异常关系不大,这两组特殊类型流产与RAAs之间的关系还需要更大样本量的研究来证明。
所有型别的染色体核型异常都可能引起流产[18,22-23]。本文统计的RAAs涉及的染色体包括2、3、4、5、6、7、8、9、10、11、12、14、15、16、20、22号染色体等16条,未见1、17、19号染色体非整倍体,这种差异可能是由于样本量较少所致。其中发生频次较高的依次为16号(43.0%)、22号(24.4%)和15号(9.3%)染色体异常,与先前研究报道基本一致[15, 18]。这种差异可能与染色体中的基因数量有关[24],高发的RAAs如16、22、15号染色体上含有800~1 600个基因,要少于其他RAAs(约含有1 600~5 000个基因),可能存在一个阈值效应决定敏感基因的功能及表达。
不同RAAs对胎儿发育的影响可能不同,有国内外研究学者表明1~22号常染色体非整倍体均会导致孕妇在孕早期发生流产[14, 25]。本文对涉及的16条常染色体非整倍体胚胎/胎儿发育的孕周做了分析,各RAAs普遍在8~12周内发生流产,与以往研究一致。多数RAAs能发育到的最大孕周不超过早孕期,少数仅可发育到中孕期。部分嵌合体可发育到较大孕周。其中,有1例16号三体嵌合38%和1例20号三体嵌合25%的胎儿发育到19周时,两位孕妇要求终止妊娠。另有1例羊水中2号三体嵌合44%的胎儿,排除了单亲二体(UPD)且无超声异常,孕妇经产前门诊咨询后,继续妊娠至足月分娩,随访新生儿3年余,未见发育异常。三体自救是一种可能的解释,比如内细胞团的一些三体细胞随机丢失一条染色体变成二体细胞,机体对二体细胞进行有效选择,三体细胞存在于胎盘中,导致胎盘,羊水和胎儿之间存在细胞遗传学差异[26]。因此,本研究推测胎儿细胞核型有可能为正常二倍体,而羊水细胞为2号三体嵌合体,胎盘为2号三体或三体嵌合体。此外,有研究表明低比例嵌合与良性的胎儿发育有关,Chen等[27]和Tang等[28]分别报道1例羊水中2号三体嵌合3%和4%的病例,脐血核型和孕期超声均正常,生后随访发育正常,但是目前尚未有指南或共识指出嵌合比例低于多少,胎儿妊娠结局良好。这一结果提示,对于产前诊断为嵌合型RAAs的孕妇,需进行详细的产前咨询,密切监测孕妇超声和孕期情况,必要时对夫妻双方行染色体检测。妊娠终止后建议对胚胎/胎儿/新生儿及胎盘行细胞遗传学检测,进一步明确RAAs嵌合部位与比例,对新生儿提供正确的临床指导或干预,并为流产/引产患者健康孕育下一胎提供理论依据。
综上,本文从罕见常染色体非整倍体的角度分析了其对胚胎/胎儿发育的影响, 绝大多数RAAs与稽留流产相关,且多数流产发生于早孕期,少数胎儿能发育到中孕期。嵌合型RAAs可发育到的孕周与胚胎的嵌合部位和比例有关,嵌合比例较低或胚胎染色体在早期发生自救,胎儿可以正常发育至足月出生。本文提示临床实践中应重视RAAs,RAAs是流产的重要原因,有必要提高临床医生及广大孕妇群体对此的认知。
1 汤冬玲.用核型分析和荧光原位杂交技术检测早期自然流产胚胎染色体异常.中国优生与遗传杂志,2014,22:59-60,116.
2 陈秀菊,蔡满满,张丽荣.孕早期静脉导管A波倒置联合NT筛查胎儿染色体非整倍体价值.中国计划生育学杂志,2020,28:1984-1987.
3 Xie MJ,Liang ZK,He D,et al.Noninvasive Prenatal Testing of Rare Autosomal Aneuploidies by
Semiconductor Sequencing.DNA Cell Biol,2018,37:174-181.
4 Mark DP,Meredith HM,Nicola F,et al.Rare autosomal trisomies,revealed by maternal plasma DNA sequencing,suggest increased risk of feto-placental disease.Sci Transl Med,2017,9:1-11.
5 潘瓷,任方,栗梦梦,等.132例产前诊断21三体胎儿的临床病例分析.中国实用医刊,2022,49:1-4.
6 赵燕,曹鲁泉,刘真真,等.245例自然流产组织染色体异常分析.中华围产医学杂志,2019,22:331-335.
7 谢辛,孔北华,段涛,主编.妇产科学.第九版.北京:人民卫生出版社,2018:70-72.
8 夏政怡,周冉,孟露露,等.染色体微阵列分析技术在偶发自然流产遗传学诊断中的应用.现代妇产科进展,2022,31:191-195.
9 侯东霞,侯丽青,乌云塔娜,等.妊娠中期鼻骨发育异常胎儿的染色体检测结果及相关因素分析.中国全科医学,2021,24:696-700+711.
10 邵雨菡,颜军昊.染色体异常与自然流产.中国实用妇科与产科杂志,2020,36:1045- 1050.
11 高鹏,蓝惠华,金丹丹,等.NGS技术对325例自然流产组织染色体异常检测结果分析.国际医药卫生导报,2018,24:1920-1923.
12 Zhang T,Sun Y,Chen Z,et al.Traditional and molecular chromosomal abnormality analysis of products of conception in spontaneous and recurrent miscarriage.BJOG,2018,125:414-420.
13 王珺,陈书强,高玲霞,等.1317例早期流产患者绒毛染色体检测结果分析.生殖医学杂志,2019,28:7-11.
14 莫晓珊,陈颖,杜涛,等.1713例早期自然流产胚胎的染色体核型分析.中华医学遗传学杂志,2016,33:581-583.
15 侯东霞,侯丽青,乌云塔娜,等.基于微阵列技术分析胚胎停育绒毛组织中的染色体异常.实用医学杂志,2020,36:2655-2660.
16 Quenby S,Gallos ID,Dhillon-Smith RK,et al.Miscarriage matters:the epidemiological,physical,psychological,and economic costs of early pregnancy loss.Lancet,2021,397:1658- 1667.
17 Zhao L,Yang H,Liu G.Relationship between age at menarche and chromosome numerical abnormalities in chorionic villus among missed abortions:A cross-sectional study of 459 women in China.J Obstet Gynaecol Res,2020.doi:10.1111/jog.14499.Online ahead of print.
18 闵爱萍,许洪梅,冯欣,等.100例稽留流产的病因分析.广东医学院学报,2022,40:222-225.
19 Ticconi C,Pietropolli A,Specchia M,et al.Pregnancy-Related Complications in Women with Recurrent Pregnancy Loss:A Prospective Cohort Study.J Clin Med,2020,9:2833.
20 Teklenburg G,Salker M,Heijnen C,et al.The molecular basis of recurrent pregnancy loss:impaired natural embryo selection.Mol Hum Reprod,2010,16:886-895.
21 钟汉威,丁海刚,张峰.流产合并感染93例临床分析.浙江省妇产科学、围产医学学术年会暨妇产科常见疾病规范化治疗新进展、围产医学现状与进展专题学术论坛论文汇编,2014:188.
22 袁思敏,徐霞,廖灿,等.335例早期自然流产患者胚胎绒毛染色体分析.中国妇幼健康研究,2020,31:1190-1198.
23 Terry JH,Patricia AJ.Trisomy in man.Annu Rev Genet,1984,18:69-97.
24 Zhou Q,Wu SY,Amato K,et al.Spectrum of Cytogenomic Abnormalities Revealed by Array Comparative Genomic Hybridization on Products of Conception Culture Failure and Normal Karyotype Samples.J Genet Genomics,2016,43:121-131.
25 刘海珍,邵小光,孙秀静.早期自然流产患者绒毛染色体检测结果分析.华南预防医学,2021,47:1572-1574.
26 Chen CP,Su YN,Lin SY,et al.Prenatal diagnosis of mosaic trisomy 2:discrepancy between molecular cytogenetic analyses of uncultured amniocytes and karyotyping of cultured amniocytes in a pregnancy with severe fetal intrauterine growth restriction.Taiwan J Obstet Gynecol,2011,50:390-393.
27 Chen CP,Hung FY,Chern SR,et al.Application of interphase FISH to uncultured amniocytes for rapid confirmation of true trisomy 2 mosaicism in the case of suspected amniocyte mosaicism involving trisomy 2 in a single colony.Taiwan J Obstet Gynecol,2013,52:300-302.
28 Tang W,Zhang Q,Yue Z,et al.Prenatal diagnosis of mosaicism for trisomy 2 in a single colony at amniocentesis with a favorable outcome.Taiwan J Obstet Gynecol,2020,59:344-345.